
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И тепловой закон Нернста
|
|
|
|
Химическое равновесие
Найдем выражение для зависимости стандартной энергии Гиббса реакции от температуры без привлечения данных по энтропии веществ. В соответствии с уравнением Гиббса-Гельмгольца
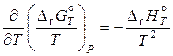 , (11.80)
, (11.80)
а согласно уравнению Кирхгофа
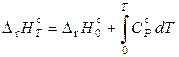 . (11.81)
. (11.81)
Следовательно,
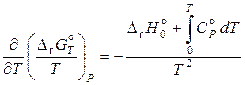 . (11.82)
. (11.82)
При интегрирования уравнения (11.82) получаем
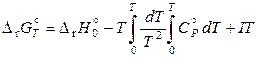 . (11.83)
. (11.83)
Из уравнений (11.81) и (11.83) следует, что для определения стандартных энтальпии и энергии Гиббса реакции при заданной температуре Т необходимы следующие данные:
1) изменение теплоемкости в ходе реакции в интервале от 0 К до Т;
2) тепловой эффект реакции при 0 К;
3) постоянная интегрирования I.
Первые два параметра определяются по термохимическим данным для реагирующих веществ. Константу I можно рассчитать на основе определенной опытным путем стандартной константы равновесия исследуемой реакции хотя бы при одной температуре (что, как правило, сопряжено с большими экспериментальными трудностями), поскольку
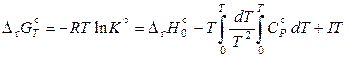 .
.
Если значение стандартной энергии Гиббса реакции неизвестно ни при одной температуре, то постоянная I остается неопределенной. Проблема определения константы I, минуя экспериментальное исследование химического равновесия, решается с помощью теплового закона Нернста: кривые зависимостей стандартных энергии Гиббса и энтальпии реакции от температуры для любого химического процесса в конденсированных системах вблизи абсолютного нуля асимптотически приближаются друг к другу, т. е. имеют общую касательную:
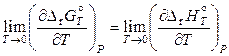 .
.
Тепловой закон (постулат, или теорема) Нернста и вытекающие из него следствия справедливы только для систем, состоящих из кристаллических, полностью равновесных веществ. Согласно уравнению (11.83) при абсолютном нуле
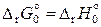 , (11.84)
, (11.84)
поэтому общая касательная к кривым
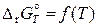 и
и 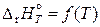
при Т = 0 К проходит горизонтально (параллельно оси температур). Следовательно,
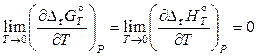 .
.
Поскольку
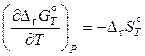 и
и 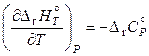 ,
,
то
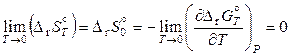 , (11.85)
, (11.85)
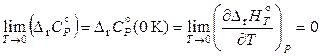 . (11.86)
. (11.86)
При температурах, близких к 0 К, процессы в конденсированных системах протекают без изменения энтропии и теплоемкости. Энтропии кристаллических веществ одинаковы при абсолютном нуле (согласно постулату Планка равны нулю).
Рассмотрим еще некоторые следствия из теоремы Нернста.
1) Константа интегрирования I для реакций между кристаллическими веществами равна нулю:
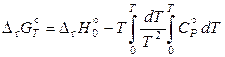 .
.
2) Абсолютный нуль температур недостижим, так как
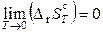 .
.
При приближении температуры к 0 К изотермические процессы становятся адиабатическими, а поскольку отсутствует теплообмен, то и дальнейшее понижение температуры невозможно.
3) Вблизи абсолютного нуля объем кристаллического вещества не зависит от температуры. Действительно, энтропия вещества при Т → 0 К стремится к постоянной величине, поэтому
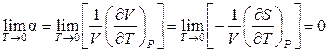 . (11.87)
. (11.87)
4) Вблизи абсолютного нуля разность изобарной и изохорной теплоемкостей вещества стремится к нулю, поскольку
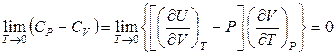 . (11.88)
. (11.88)
Как показывает опыт и квантовая теория, при Т → 0 К не только разность, но и сами теплоемкости СР и СV стремятся к нулю, т. е.
 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 557; Нарушение авторских прав?; Мы поможем в написании вашей работы!