
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия как функции состояния
|
|
|
|
Понятие об энтропии можно ввести термодинамически, если связывать рассеивание энергии с количеством теплоты, поступившей в систему, или статистически, если придерживаться точки зрения, что рассеивание энергии среди компонентов системы может быть вычислено.
Энтропия (от греческого entropia – поворот, превращение) – понятие, впервые введенное в термодинамике для определения меры необратимости рассеивания энергии. В статистической физике энтропия – мера вероятности осуществления какого-либо макроскопического состояния.
В термодинамике понятие «энтропия» введено Р. Клаузиусом в 1865 году. Клаузиус показал, что процесс превращения теплоты в работу подчиняется второму закону термодинамики, который можно сформулировать строго математически, если ввести новую функцию состояния – энтропию S. Энтропия была введена на основе доказательства теоремы Карно о независимости термического КПД обратимого цикла Карно от природы рабочего тела. Здесь напомним, что КПД тепловой машины при работе по обратимому циклу определяется выражением (3.1), которое можно записать в таком виде
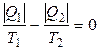 . (3.6)
. (3.6)
По принятой в термодинамике системе знаков Q 2 < 0, поэтому уравнение (3.6) можно записать
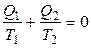 . (3.7)
. (3.7)
Для элементарного цикла Карно, осуществляемого между температурами Т 1 и Т 2, получим
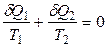 .
.
Величину δQ / T называют приведенной теплотой. Любой обратимый цикл можно заменить бесконечно большим числом бесконечно малых (элементарных) циклов Карно. Суммирование этих циклов дает
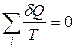 .
.
Если i → ∞, то суммирование превращается в интеграл по замкнутому контуру
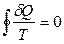 , (3.8)
, (3.8)
т.е. алгебраическая сумма приведенных теплот любого обратимого кругового процесса равна нулю. Но если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции состояния системы. Итак,
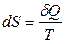 ,
,
где S – функция состояния системы – энтропия.
Приведенные рассуждения применимы к любому веществу и к любому обратимому циклу. Поэтому каждая система в любом ее состоянии имеет определенное значение энтропии.
Можно рассуждать и так: для простой системы, совершающей только работу расширения, справедливо:
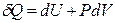 .
.
Если система – 1 моль идеального газа, то
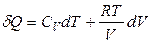 ,
,
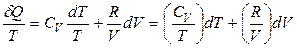 .
.
Если T и V – независимые параметры, то можно найти перекрестные проиводные и убедиться в том, что они равны:
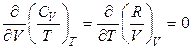 ,
,
Следовательно, для идеального газа приведенная теплота
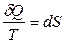
обладает свойствами полного дифференциала и, значит, энтропия есть функция состояния. Распространение последнего выражения на все системы можно рассматривать как второй закон термодинамики.
Далее, разность энтропий системы в двух произвольных состояниях 1 и 2 равна
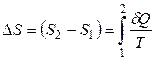 . (3.9)
. (3.9)
Интегрирование ведется вдоль пути любого обратимого процесса, связывающего состояния 1 и 2, при этом приращение энтропии ∆ S не зависит от пути интегрирования.
Таким образом, существует однозначная функция состояния S – энтропия, которая при обратимых адиабатических процессах (Q = 0 ) остается постоянной. Процессы, в которых энтропия остается постоянной, называются изоэнтропийными.
Для необратимых процессов интеграл от приведенной теплоты δQ / T по замкнутому контуру отрицателен
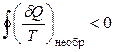 . (3.10)
. (3.10)
Тогда справедливо, что
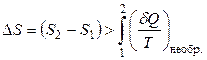 , (3.11)
, (3.11)
поэтому энтропия адиабатически изолированной системы при необратимых процессах может только возрастать. Таким образом, энтропия определяет характер процессов в адиабатических условиях: возможны только такие процессы, при которых энтропия либо остается неизменной (обратимые процессы), либо возрастает (необратимые процессы). При этом не обязательно, чтобы возрастала энтропия каждого из тел, участвующих в процессе. Увеличивается общая сумма энтропий участвующих в процессе тел:
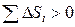 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3658; Нарушение авторских прав?; Мы поможем в написании вашей работы!