
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В общем виде второй закон термодинамики записывается
|
|
|
|
 , (3.12)
, (3.12)
где знак равенства относится к обратимым процессам, а знак неравенства – к необратимым процессам.
Напомним, что в обратимых процессах система выполняет максимальную работу, а потерянная работа в реальных процессах всегда больше нуля:
 . (3.13)
. (3.13)
Из закона сохранения энергии следует, что энергетический эквивалент «потерянной» работы не может исчезнуть совсем. Опыт показывает, что «потерянная» работа чаще всего переходит в теплоту. Тогда в балансе теплоты и работы при необратимых процессах следует учитывать дополнительный внутренний источник теплоты:
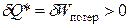 (3.14)
(3.14)
Величину δQ * называют некомпенсированной теплотой независимо от физической природы работы. Переход потерянной работы в теплоту – это особеность теплоты как микроскопически неупорядоченной формы передачи энергии. Поэтому строго неравенство (3.12) следует записывать так:
 , (3.15)
, (3.15)
где δQe – теплота, которой система обменивается с окружающей средой.
Особенность теплообмена при необратимых процессах состоит в появлении нового источника теплоты – некомпенсированной теплоты. Уравнение баланса энтропии можно выразить равенством
 , (3.16)
, (3.16)
или
 , (3.17)
, (3.17)
где вклад dSe связан с переносом тепла извне (из окружающей среды), а вклад dSi обусловлен необратимыми изменениями внутри системы:
dS i > 0 для необратимых процессов и dS i = 0 для обратимых процессов.
Статистическая физика связывает энтропию с вероятностью осуществления данного макроскопического состояния системы. Энтропия определяется через логарифм статистического веса Ω (термодинамическая вероятность) данного равновесного состояния:
 , (3.18)
, (3.18)
где Ω(ε,N) – число квантовомеханических уровней энергии в узком интервале энергии Δ ε вблизи значения энергии ε системы из N частиц; в классической статистической физикеΩ – величина объема в фазовом пространстве системы при заданных ε и N. Впервые связь энтропии с вероятностью состояния системы установилЛ. Больцман в 1872 году: возрастание энтропии системы обусловлено ее переходом из менее вероятного состояния в более вероятное. Изолированная система эволюционирует в направлении наиболее вероятного распределения энергии по отдельным подсистемам.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1012; Нарушение авторских прав?; Мы поможем в написании вашей работы!