
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соотношения Максвелла
|
|
|
|
Если функции состояния U, H, A, G выразить через их естественные переменные, то они обладают свойством характеристичности и называются термодинамическими потенциалами. Их дифференциалы являются полными, и для простых систем при обратимом протекании процессов равны:
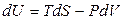 , (4.90)
, (4.90)
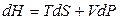 , (4.91)
, (4.91)
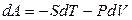 , (4.92)
, (4.92)
 . (4.93)
. (4.93)
Используя независимость второй смешенной производной функции двух переменных от порядка дифференцирования, получим:
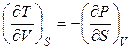 , (4.94)
, (4.94)
 , (4.95)
, (4.95)
 , (4.96)
, (4.96)
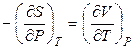 . (4.97)
. (4.97)
Соотношения (4.94) – (4.97) называются уравнениями Максвелла. Уравнения Максвелла могут быть записаны и в «перевернутом» виде:
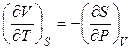 и т.д.
и т.д.
Все четыре уравнения Максвелла представляют собой, с одной стороны, производные энтропии или по давлению, или по объему, а с другой стороны, производные объема или давления по температуре. Уравнения Максвелла часто используются в математическом аппарате химической термодинамики.
Так, уравнения (4.96) и (4.97) используют для вычисления энтропии как функции Р и Т или V и Т. Например, для процесса изотермического повышения давления из (4.97) получаем
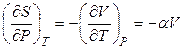 ,
,
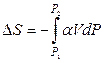 . (4.98)
. (4.98)
Если принять, что α и V конденсированной фазы не зависят от давления (жидкость или кристалл являются несжимаемым телом), то
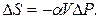 (4.99)
(4.99)
Уравнение (4.96) также может быть использовано в теории фазовых равновесий. Для гетерогенного равновесия давление является функцией одной переменной – температуры. Поэтому
 .
.
Значение рассматриваемой производной зависит только от температуры и при Т = const остается постоянной. Поэтому для фазового перехода соотношение (4.96) можно записать в следующем виде:
 ,
,  ,
,
а после интегрирования получаем
 (4.100)
(4.100)
где Δtr H – теплота фазового перехода, Δtr V – изменение объема при переходе такого же количества вещества, к которому отнесено Δtr H. Уравнение (4.100) и есть знаменитое уравнение Клапейрона-Клаузиуса.
Частные производные химической термодинамики чрезвычайно полезны при решении самых разнообразных задач. При этом следует помнить, что
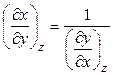 ,
,  .
.
Например, требуется найти зависимость изобарной теплоемкости вещества от давления при постоянной температуре. С учетом преобразованного выражения (4.26) и соотношения (4.97)
 ,
,  ,
,
получаем
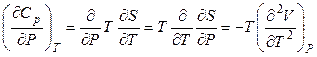 (4.101)
(4.101)
Таким образом, если наблюдается близкая к линейной зависимость объема от температуры, то изобарная теплоемкость не изменится. Для количественных расчетов необходимо иметь очень точное уравнение состояния данного вещества.
Другой пример: требуется определить, как изменится температура жидкости в результате ее адиабатического обратимого сжатия. Обратимый адиабатический процесс является изоэнтропийным, поэтому необходимо оценить производную  .
.
Если рассматривать  , то
, то
 ,
,

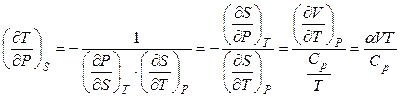 . (4.102)
. (4.102)
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2658; Нарушение авторских прав?; Мы поможем в написании вашей работы!