
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Избыточные термодинамические функции
|
|
|
|
Термодинамическая классификация растворов.
В термодинамике реальных растворов важную роль играют избыточные термодинамические функции (смешения). Избыточной функцией (смешения) называется разность между функциями смешения данного реального раствора и идеального раствора той же концентрации:
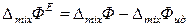 . (8.54)
. (8.54)
(Избыточная термодинамическая функция – избыток функции реального раствора от функции идеального раствора).
Функции смешения идеальных жидких растворов такие же, как и для смесей идеальных газов (глава 7), и в расчете на 1 моль раствора определяются выражениями:
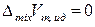 ,
, 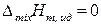 ,
,
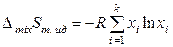 ,
, 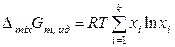 .
.
Следовательно, для молярных избыточных функций реальных растворов в общем случае справедливо:
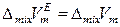 ,
, 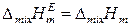 ,
,
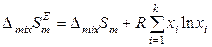 ,
, 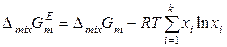 .
.
Соотношения между функциями смешения и между избыточными функциями такие же, как и термодинамические соотношения для чистых компонентов.
Определим избыточные термодинамические функции через активности и коэффициенты активности компонентов раствора. Химические потенциалы i -го компонента в идеальном и реальном растворах в общем случае могут быть определены как
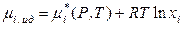 , (8.55)
, (8.55)
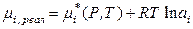 . (8.56)
. (8.56)
Тогда избыточный химический потенциал i -го компонента равен
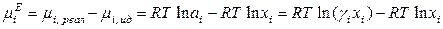 ,
,
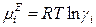 . (8.57)
. (8.57)
Молярная энергия Гиббса раствора (многокомпонентной системы) в изобарно-изотермических условиях равна
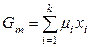 , (8.58)
, (8.58)
следовательно, избыточная энергия Гиббса с учетом (8.57) определяется выражением
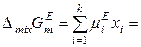
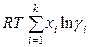 . (8.59)
. (8.59)
Выражение (8.59) можно получить и другим способом. Молярная энергия Гиббса реального раствора и его молярная энергия Гиббса смешения в соответствии с (8.56) и (8.58) равны
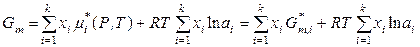 , (8.60)
, (8.60)
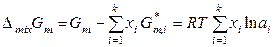 . (8.61)
. (8.61)
Тогда избыточная энергия Гиббса раствора определяется уравнением
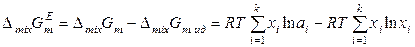 ,
,
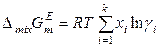 .
.
Теперь найдем выражения для расчета избыточных энтропии и энтальпии реального раствора. Для чистых компонентов выполняются соотношения
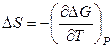 ,
, 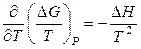 ,
,
поэтому для раствора постоянного состава справедливо:
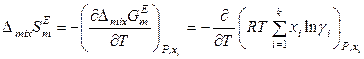 ,
,
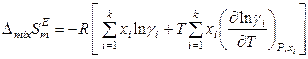 ; (8.62)
; (8.62)
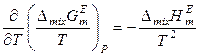 ,
,
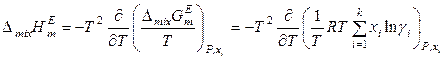 ,
,
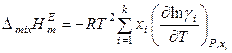 . (8.63)
. (8.63)
Выражение (8.63) можно получить и на основе соотношения
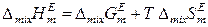
с учетом уравнений (8.59) и (8.62). Таким образом, знание коэффициентов активности компонентов и их температурных зависимостей позволяет определить при заданной температуре избыточные энергию Гиббса, энтропию и энтальпию реального раствора и, следовательно, его термодинамические функции смешения. Если к тому же известны термодинамические функции чистых компонентов, то можно рассчитать интегральные термодинамические функции данного раствора. Например:
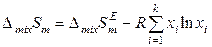 ,
,
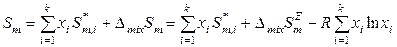 ,
,
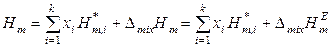 .
.
Если известна зависимость коэффициентов активности компонентов от давления, то можно вычислить избыточный объем раствора:
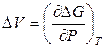 ,
,
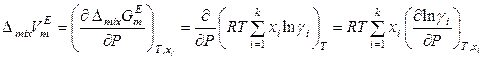 . (8.64)
. (8.64)
В настоящее время на основе представлений об избыточных термодинамических функциях общепринята следующая классификация растворов:
1) Идеальные растворы, для которых
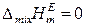 ,
, 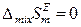 ,
, 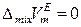 .
.
2) Регулярные растворы, для которых
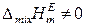 ,
, 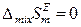 ,
, 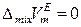 .
.
3) Атермальные растворы, для которых
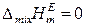 ,
, 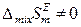 ,
, 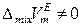 .
.
4) Реальные растворы, для которых
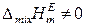 ,
, 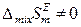 ,
, 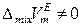 .
.
Для регулярных растворов, следовательно, выполняются следующие соотношения:
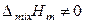 ,
, 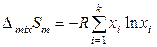 ,
, 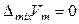 .
.
Энтальпия смешения таких растворов невелика, поэтому можно предположить, что энергии взаимодействия однородных и разнородных молекул в растворе примерно одинаковы и пространственное распределение молекул в растворе остается хаотическим. Небольшое различие в энергиях взаимодействия однородных и разнородных молекул не вызывает увеличения числа однородных (или разнородных) молекулярных пар по сравнению со средним статистическим. Энтропия смешения регулярных растворов приближенно равна энтропии смешения идеальных растворов. Регулярные растворы обычно образуются при взаиморастворении органических веществ, молекулы которых имеют близкие размеры.
Для атермальных растворов справедливо:
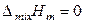 ,
, 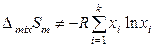 ,
, 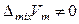 .
.
Атермальные растворы можно рассматривать как идеальные по своим энергетическим свойствам растворы, которые не подчиняются закону Рауля из-за существенного различия в размерах молекул компонентов (значительного различия в молекулярных объемах). Увеличение различия между мольными объемами приводит к отрицательным отклонениям от закона Рауля. Атермальные растворы являются предельным случаем, к которому близки растворы неполярных компонентов с сильно различающимися молекулярными объемами, например, растворы полимеров в своих мономерах.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3425; Нарушение авторских прав?; Мы поможем в написании вашей работы!