
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кишечная непроходимость
|
|
|
|
Отсутствие в фундаментальных литературных источниках специальных разделов, посвященных вопросам инфузионной терапии острой кишечной непроходимости, позволяет считать целесообразной и своевременной попытку восполнить этот пробел. Однако решение этой важной задачи оказывается весьма сложным, так как инфузионное лечение должно основываться не столько на клинических проявлениях заболевания, сколько на его патогенезе.
При рассмотрении патогенеза острой кишечной непроходимости в свете применения инфузионной терапии особое внимание следует уделять вопросам водно-солевого обмена, коллоидно-осмотического давления, волемии и др., которые изучены недостаточно [Дедерер Ю. М., 1971].
Патогенез и клиника. Проявления острой кишечной непроходимости обусловлены ее патогенезом и уровнем возникшей патологии. Тяжесть течения болезни во многом зависит от причины непроходимости — обтурации или странгуляции.
Перерастяжение стенки кишки выше места препятствия вызывает потерю в первую очередь плазмы, а затем и эритроцитов. Впоследствии этот участок кишки подвергается некробиотическим изменениям с развитием патогенной микрофлоры и выделением токсических продуктов, вызывающих интоксикацию организма.
По тяжести клинического состояния больных можно разделить на 4 группы [Лукомский Г. И. и др., 1975].
1. Состояние удовлетворительное,ОЦК, содержание белков, состав электролитов без особых изменений.
2. Состояние средней тяжести, отмечаются дефицит ОЦК до 27%, ОЦП—до 20%, ОЦНЬ—до 37%, гипо- и диспротеинемия со снижением онкотического давления плазмы до 2,6 кПа (20 мм рт. ст.), снижение содержания электролитов в крови (натрия на 24%, калия на 20%).
3. Состояние тяжелое, длительность заболевания более суток. Прогрессируют нарушения гемодинамики, водного баланса, дефицит альбумина достигает 70%, онкотическое давление плазмы снижено до!,7кПа (13мм рт. ст.), увеличивается дефицит калия и натрия.
4. Состояние крайне тяжелое, наблюдаются резкие нарушения гемодинамики, нитевидный пульс, низкое (или неопределяемое) артериальное давление, резкая степень дегидратации. Дефицит ОЦК до 48%, ОЦП до 52%, объем циркулирующего белка до 50%, онкотическое давление плазмы менее 1,7 кПа (13 мм рт. ст.), дефицит натрия в плазме 38%, калия — 46%.
Патофизиологические сдвиги протекают в определенной последовательности; фаз но ГЛукомский Г. И., Могилевский И. Л., 1977].
I фаза — относительное благополучие, волемические и другие показатели находятся на нормальном уровне.
II фаза — наблюдается потеря воды, солей, белков (в частности, альбуминов). Однако онкотическое давление плазмы крови может оставаться без изменений за счет компенсаторного увеличения концентрации а-глобули-нов.
Ill фаза—в результате развившейся гиповолемии происходит возбуждение объемных рецепторов и повышается секреция альдостерона, усиливающего реабсорбцию натрия в почечных канальцах. Возрастает осмотическое давление плазмы, увеличивается выработка антидиуретического гормона, способствующего наводнению сосудистого русла и восстановлению ОЦК.
IV фаза — декомпенсация, когда дефицит всех факторов гемодинамики и обмена веществ достигает критического или необратимого уровня.
Ведущим фактором патогенеза острой кишечной непроходимости является резкое нарушение водного обмена.
Вода в организме человека составляет 65—70% массы тела, т.е. в среднем 40—50 л. Потеря 20% воды несовместима с жизнедеятельностью организма, дефицит 8—10 л воды представляет опасность для жизни. Основная масса воды находится в клетках организма (35—40 л); в интерстиции содержится 10—12 л, в сосудистом русле — 3—4 л.
Ежедневно в организм человека поступает в среднем 2,7 л экзогенной жидкости, из которой питьевая вода составляет в среднем 1,5 л, с пищей — 1,2 л. Кроме того, в результате окисления жиров в организме образуется эндогенно 0,3 л воды. Следовательно, прирост воды в сутки у здорового человека составляет в среднем 3 л. Такое же количество жидкости выделяется за сутки: через почки — 1,4 л (0,5 л обязательно и 0,9 л дополнительно), при дыхании — 0,4 л, через кожу — 0,6 л, при потоотделении — 0,5 л, с калом — 0,1 л. Следовательно, так называемые невидимые потери составляют в среднем 1,6 л.
В 1-е сутки острой кишечной непроходимости потеря воды составляет 1—1,5л. В более поздние сроки она увеличивается и к концу 3—4-х суток может достигать 5—6 л, в составе которых значительную роль могут играть «незаметные» потери [Дедерер Ю. М., 1971].
Потеря организмом воды происходит неодинаково в различных водных секторах. Так, внеклеточная дегидратация развивается, как правило, вследствие потери организмом солей, что имеет место при рвоте, поносе, дренировании содержимого желудка. Клинически это проявляется гиповолемией, гипотонией, тахикардией, бледностью и сухостью слизистых и кожных покровов, языка, тошнотой и рвотой, снижением диуреза и повышением остаточного азота крови, осмотической гипотонией плазмы, сгущением крови. Дифференциальным признаком внеклеточной дегидратации является отсутствие жажды.
Клеточная дегидратация развивается как при значительных потерях воды и малых потерях солей, так и при повышенной концентрации солей и малых потерях воды (гипертоническая дегидратация). Клиническим выражением этих сдвигов являются нарушения функций ЦНС (апатия, сонливость, беспокойство, мышечные подергивания, галлюцинации), повышение температуры тела, увеличение содержания в крови натрия, осмотическая гипертония плазмы, олигурия. Основным клиническим симптомом считают мучительную жажду.
Начальная стадия обтурационной непроходимости тонкой кишки не отличается особыми сдвигами со стороны гемодинамики и состава крови. Потери воды и электролитов выражены незначительно. В пределах 24 ч ге-модинамика удерживается на уровне нормы, ОЦК снижается не более чем на 15—20%, гематокрит увеличивается на 10—12%.
Сохраняющаяся на протяжении нескольких суток обтурация кишки усугубляет гиповолемию, появляются гипотония и тахикардия, нарушается ионное равновесие в плазме крови (преимущественно в сторону дефицита натрия, кальция, калия и хлора). Постепенно развивается метаболический алкалоз, нарушается функция почек. Дальнейшая секвестрация жидкости в просвет кишечника вызывает внеклеточную дегидратацию, сгущение крови, повышение содержания в плазме ионов калия.
Обтурационная непроходимость толстой кишки на поздних стадиях развития заболевания (10—14 дней) отличается разжижением крови за счет повышения содержания в ней воды (плазматическая гипергидратация). В клеточном секторе может наблюдаться резкий дефицит ионов калия. Однако клеточно-плазменный градиент по калию увеличива-
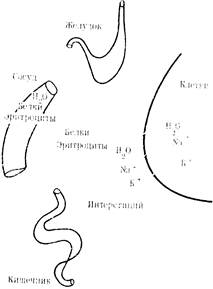
| Рис. 14. Схема нарушении водно-электролитного оа-ланса при оГл-урационнои форме острой кишечной непроходимости |

ется в 2—3 раза, что свидетельствует об увеличении интенсивности метаболизма в клетках (рис. 14). Клинически это может проявляться парезом желудка, рвотой, усиленным метеоризмом, нарушением гемодинамики.
Странгуляционная форма кишечной непроходимости характеризуется быстрыми и значительными потерями жидкости. Экспериментальные исследования И. Ф. Матюшина и Г. А. Максимова (1975) показали, что гематокрит увеличивается за счет дегидратации крови до 70%, клеточный сектор при этом резко гидратирован. ОЦП снижается на 8—10%. В миокарде и почках происходит гипергидратация на 5—9%, в мозге и печени — на 18—26%. При этом имеет место выраженный внутриклеточный дефицит калия: в головном мозге на 26—44%, в миокарде — на 13—41%, в почках — на 29—47%. В то же время..концентрация иона натрия возрастает в среднем на 30—50%.
Другой особенностью странгуляционной непроходимости кишечника является потеря больших количеств эритроцитов через стенку измененной кишки выше места препятствия. Транссудат в брюшной полости становится геморрагическим. Особенно большие потери эритроцитов наблюдаются при узлообразованиях и заворотах обширных отделов кишки (рис. 15). Эти потери могут составлять 50% исходного ОЦК [Дедерер Ю. М„ 1970].
Определенное значение в патогенезе острой кишечной непроходимости, особенно при ее странгуляционной форме, имеет потеря белков. Это объясняется тем, что они не только выходят через стенку ущемленной кишки в транссу-
|
дат, где их концентрация может достигать 25— 50 г/л, но и усиленным катаболизмом. В основ ном теряются альбуми ны, в меньшей степени— глобулины. Процентное содержание последних возрастает. Это являет ся результатом того,что альбумины более дисперсны и легче про никают через стенку сосудов, снижая тем самым коллоидное давление плазмы крови.
| Рчс. 15. Схема нарушений водно ^.лектр слитного бялапс... при стрянгу.-'яционной форме острой кишечной «е-проходимости. |
При острой кишеч ной непроходимости на рушается углеводный об мен, что выражается в повышении содержания в крови сахара на фоне сниженной продукции гликогена, особенно в печени и мышцах. Наря ду с этим можно отметить и нарушение окислительно-восстановительных процессов, связанных с ухудшением реологических свойств крови, способствующих снижению скорости кровотока в системе микроциркуляции, депонированию в капиллярах эритроцитов, их аг регации и стазу.
Тяжесть заболевания в определенной степени обусловливается интоксикацией организма, усиливающейся по мере развития процесса. Она бывает особенно выражена при тромбозах брыжеечных сосудов, сопровождающихся, как правило, некрозом обширных участков тонкой кишки. В этих условиях микроорганизмы легко проникают из просвета кишки в брюшную полость, вызывая перитонит. В паренхиматозных органах, например в печени, почках, наблюдаются явления некроза.
Исходя из патогенеза острой кишечной непроходимости, при инфузионной терапии необходимо провести три основных мероприятия: 1) ограничить дальнейшие потери организмом жидкости, солей, белков и эритроцитов в брюшную полость или просвет кишечника; 2) быстро восполнить потери и восстановить гомеостаз в ранние сроки с учетом так называемых невидимых потерь (табл. 6); 3) обеспечить достаточно полное парентеральное питание, устраняющее дефицит внутриклеточных белков путем сдерживания процессов катаболизма.
В осуществлении инфузионной терапии следует четко различать два этапа — предоперационную подготовку и послеоперационный период.
Предоперационная коррекция гомеостаза. В первую очередь следует стремиться к ликвидации гиповолемии, для чего рекомендуется инфузия коллоидных препаратов, обладающих высоким гемодинамическим эффектом. Для восполнения водных и электролитных потерь необходимо вливание кристаллоидных растворов типа раствора Рингера, лактасо-ла и др. Объем инфузионной терапии зависит от тяжести состояния больного и давности заболевания. Не следует стремиться оперировать больного, не проведя корригирующую терапию в течение 1—3 ч.
Таблица 6. Определение «незаметных» потерь воды у больных с острой кишечной непроходимостью с учетом эндогенной воды [Дедерер Ю. М., 1971]*
| больною, I | :«) Ч | 4К ч | ———————— |
| 40-50 0,4.0,5 I 0,8- -1,0 | 1.2-1,5 | 1,7 2,0 | 2,5 2,8 |
| 60 70. 0,5 0.6 ' 1,1- 1,2 | 1,6 1,8 2,2—2,4 | 3,4—3,6 | |
| 80—90 1 0,7- 0,8 i 1.3 1,5 | 2,0—2,2 2,6-2,9 | 4.0- 4,3 |
Как отмечалось выше, острая обтурационная кишечная непроходимость протекает с потерей воды, солей и белков, но без выраженной потери эритроцитов. Лечение таких больных должно осуществляться главным образом вливанием водно-солевых растворов. Учитывая развивающийся ацидоз, связанный на первых порах с ухудшенным газообменом на почве нарушенной гемодинамики, показано вливание ощелачивающих растворов типа лактасола. Может быть использован также 4% раствор бикарбоната натрия, трис-буфер или ТНАМ. Объем инфузии указанных растворов при выраженных явлениях гипоксии и ацидоза может достигать 1-1,5 л.
Для пополнения энергетического запаса в инфузионную терапию можно включить 40% раствор глюкозы в дозе 100 мл с одновременным введением 8 ЕД инсулина.
Странгуляционная форма кишечной непроходимости протекает более тяжело, и явления обезвоживания наступают. значительно быстрее. Кроме того, при этой форме заболевания приходится учитывать анемизацию вследствие потери эритроцитов через стенку кишки.
С учетом тяжести состояния больных в предоперационном периоде при странгуляционной непроходимости показано интенсивное вливание коллоидных и кристаллоидных растворов в соотношении 1:1 в объеме 1,5—2 л со скоростью в среднем 1 л/ч. При содержании гемоглобина ниже 100 г/л показано переливание цельной донорской крови или эритро-цитной массы в объеме не более 0,5 л, чтобы не усилить нарушения микроциркуляции.
Послеоперационная трансфузионная терапия. Воздействие на организм оперативного вмешательства как такового часто выражается в усилении внешнего дыхания, ускорении кровотока, температурной реакции и т.д., что способствует увеличению «незаметных» потерь воды. В течение послеоперационных суток эти потери могут достигать 1,5—2л. Общий объем инфузии препаратов может составить 3—4 л в сутки. Возмещение водных потерь является первоочередной задачей послеоперационного периода. Для расчета суточной потребности организма больного в жидкости S. Randall (1968) предложена формула:

Можно исрользовать рекомендацию Ю. М. Дедерера (1971), согласно которой в послеоперационном периоде больной с массой тела 70 кг должен получить жидкости в среднем 3—4 л в сутки и дополнительно то количество, которое теряется через дренажи, со рвотными массами, потом, при перспирации и т.д.
В качестве основного средства компенсации жидкости могут быть использованы изотонический раствор хлорида натрия в объеме 1,5 л и более и 5—10% раствор глюкозы в объеме до 1 л. На каждый литр глюкозы следует добавлять 3 г хлорида калия и расчетную дозу инсулина.
Особое внимание следует уделить нарушениям водного обмена, затрагивающим внеклеточный и клеточный секторы.
При развитии внеклеточной дегидратации на почве возникшей внеклеточной осмотической гипотонии показано введение инфузионных растворов, сг держащих хлорид натрия. Соли натрия, выравнивая сол.вой баланс, предотвращают также развитие внутриклеточной гипогидратации. Следует отметить, что в состав инфузионной терапии в этих случаях не следует включать растворы глюкозы, так как последняя, метаболизируясь в организме, выделяет эндогенную воду, чем усиливает внеклеточную гипотонию. При лечении клеточной дегидратации, наоборот, должно
осуществляться вливание гипо- и изотонических растворов глюкозы и противопоказано введение солевых растворов, даже изотонических. Введение солей во внеклеточный сектор усиливает внеклеточную гипертонию, а следовательно, и дегидратацию клеток. При значительных «незаметных» потерях (перспирация и др.), наблюдаемых главным образом в поздние стадии развития заболевания, создается положение, когда потери воды превышают потери солей. В результате концентрация солей во внеклеточном пространстве увеличивается и дегидратация клеточного сектора носит характер гипертонической. Это состояние, как правило, сопровождается метаболическим ацидозом. Для коррекции водно-солевого обмена и кислотно-щелочного состояния показана инфузия изотонических солевых растворов, бикарбоната или лактата натрия, растворов глюкозы.
При общей дегидратации организма рекомендуется вливание изотонических растворов солей и глюкозы, но не гипертонических, так как последние могут вызвать опасную дегидратацию клеточного сектора.
Следует помнить о возможной передозировке жидкости (так называемой водной интоксикации). Клинически она проявляется повышенным выделением жидкости слюнными и слезными железами, слизистой оболочкой желудка и кишечника, скоплением жидкости в подкожной клетчатке. В тяжелых случаях отмечается повышение внутричерепного давления (головная боль, затемнение сознания, подергивание мышц, брадикардия, гипертония).
Избыточное введение в организм солей натрия сопровождается тошнотой, рвотой, анорексией, отеком гортани, легких, подкожной клетчатки, появлением гидроторакса и асцита.
Восстановление послеоперационного гомеостаза должно включать в себя, кроме нормализации водного обмена, тщательную коррекцию солевого состава внеклеточного и клеточного пространств. При недостаточности в организме солей, в частности калиевых, клинически отмечаются слабость, адинамия, беспокойство, спазм периферических сосудов, слабость сердечной деятельности. Адекватная компенсация дефицита солей калия представляет собой одну из наиболее важных задач инфузионной терапии.
Потери калия наблюдаются при избыточном выведении пищеварительных соков через зонд или с рвотными массами при обильном потоотделении. В составе мочи на 1 г избыточно выделяемого натрия калия теряется 2—3 ммоль/л [Войнар А. О., 1959]. Потери калия возможны при массивных вливаниях растворов натрия, выраженном катаболизме, сопровождающемся усиленным выделением надпочечниками альдостерона.
Роль в организме иона калия исключительно велика. Запасы его весьма значительны и составляют 175 г, т.е. в среднем 1000 ммоль/л. Малые потери клинически могут не проявляться. При вливании растворов калия следует помнить, что в клетки он проникает весьма медленно, а избыток его в плазме легко выводится почками. Поэтому вводить его следует медленно и в растворе, содержащем не более 3 г/л, т.е. 0,3% растворе.
Для компенсации калия, теряемого в составе пищеварительных соков, достаточно вливание 250 мл 0,4% раствора хлорида калия из расчета, что в каждом литре эвакуированного сока содержится 0,75 г калия. Кроме того, следует учесть, что больной за сутки выделяет калия в среднем до 100 ммоль/л, т.е. до 4 г.
Передозировка калия может вызвать остановку сердца (от 7 до 14 ммоль/л в сыворотке крови). В связи с этим его максимальная суточная доза не должна превышать 3 ммоль/л (0,22 г КС1) на 1 кг массы тела больного, т.е. 13—15 г. Скорость введения должна быть в пределах 20 ммоль/л в час (782 мг КС1). При этом диурез должен составлять в среднем 40—50 мл/ч.
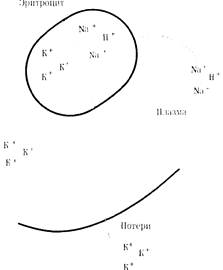
Потери плазменного калия организм компенсирует калием, проникающим из эритроцитов (рис. 16). При этом развиваются клеточный ацидоз и плазменный гипокалиеми-ческий алкалоз. Ликвидация нарушенного кислотно-щелочного состояния происходит по мере компенсации дефицита плазменного калия. При этих нарушениях показано введение 0,3% раствора калия. При нормальной функции печени можно использовать также раствор соляной кислоты или хлорида аммония.
Определенное значение в коррекции водно-солевого обмена при острой кишечной непроходимости может иметь гормональная терапия. Рассмотрение этой стороны лечения не входит в нашу задачу. Необходимые сведения изложены в
|
Рис. 16. Калиево-натриевый и и сое вслеястпие потери калия при острой ки шечнои нгпроходимости.
соответствующих руководствах. Отметим лишь, что альдосте-рон, регулирующий солевой и водный обмен, тормозит выведение с мочой солей натрия. При избытке солей в организме антидиуретический гормон задней доли гипофиза тормозит выведение воды с мочой.
Составляя схему трансфузионной терапии при острой кишечной непроходимости, можно использовать табл. 7, в которой представлены ингредиенты солевых растворов.
Таблица 7. Состав солевых растворов
| «•.„..,,...„„ | ||||
| \J | ь | (.а | (:! | |
| и (изотониче- | ||||
| — | ||||
| 1,9% | ||||
| рия (1,6 vh | ||||
| -- | ||||
| я 0,75% | .— | |||
| 0,8 | ||||
| а | 3,4 | 1,4 | ||
| rcp-.лактатный | ||||
| нор Гартмана) | 269,7 | 0,00768 | 0,003984 | 0,00282 |
Компенсация белковой недостаточности. Возникновение белковой недостаточности при острой кишечной непроходимости связано, как правило, с образованием транссудата и развитием фазы катаболизма. Потеря белков ведет к снижению онкотического давления плазмы, что способствует снижению ОЦК и на фоне потери солей приводит к падению коллоидноосмотического давления крови, а следовательно, и кровяного давления.
Белковый обмен особенно страдает при странгуляци-онной форме острой кишечной непроходимости, когда значительное количество белка депонируется или уходит с транссудатом в брюшную полость; распад белков при этом усиливается, синтез замедляется. Комплексацию дефицита белков плазмы можно осуществлять нативной донорской плазмой, денатурированными гетерогенными белками животных или коллоидными растворами. Выбор инфузи-онного средства зависит от цели лечебного мероприятия.
Для временного поддержания коллоидного давления плазмы, кровяного давления или ОЦК вполне приемлемо и целесообразно вливание декстранов, обладающих средне- и низкомолекулярной массой, близкой молекулярной массе альбумина. Однако для окончательного восстановления белкового баланса крови больного следует применять белковые препараты, из которых наиболее эффективными являются альбумин, протеин. Использование цельной донорской крови или плазмы менее желательно в связи с их высокой вязкостью и иммунной агрессивностью.
Расчет объема инфузии белков должен основываться на количестве белка, потерянного организмом, и его концентрации в переливаемом препарате. Так, плазма содержит 70—80 г/л белка, а потеря его с транссудатом составляет в среднем около 20 г/л. Следовательно, объем инфузии плазмы должен составлять У* часть объема транссудата. Однако этого недостаточно, так как потери происходят и в интерстиций, и в просвет кишки и т.д. Ю. М. Дедерер (1971) считает, что объем плазмы должен составлять /г количества транссудата.
При странгуляционной форме кишечной непроходимости содержание белка в геморрагическом выпоте составляет 25—50 г/л. Следовательно, объем возмещения этих потерь должен быть увеличен в 1!/а — 2 раза, т.е. составлять соотношение 1:1.
Преимущество вливания 5—10% раствора альбумина или 4,8% раствора протеина обусловлено тем, что при кишечной непроходимости в крови реципиента наиболее резко снижается содержание фракции альбуминов, ответственных за поддержание нормального уровня коллоидного давления плазмы.
Показанием к переливанию цельной донорской крови или эритроцитной массы является усиливающаяся анемизация организма на почве выхода из циркуляции эритроцитов, что особенно выражено при странгуляционной форме кишечной непроходимости. Эти показания становятся абсолютными, если содержание гемоглобина не превышает 100 г/л и гематокрит падает ниже 0,30 л/л.
Трансфузионная терапия сопровождающей кишечную непроходимость интоксикации заключается, прежде всего в наводнении организма с целью снижения в циркулирующей крови титра микробных токсинов. Во-вторых, это достигается путем связывания токсинов низкомолекулярными коллоидными растворами с последующим выведением их с мочой. В качестве дезинтоксикационного инфузионного раствора широко используют гемодез. Более эффективен неогемодез, имеющий молекулярную массу в среднем 8000 ± 2000. Препарат содержит ионы натрия, калия, кальция и хлора. Дезинтоксикационный эффект начинает проявляться сразу после начала инфузии препарата. Разовая доза 400 мл. Препарат выводится почками в течение 3—12 ч. При необходимости прибегают к методике форсированного диуреза, как описано в разделе, посвященном лечению перитонита.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1333; Нарушение авторских прав?; Мы поможем в написании вашей работы!