
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая связь
|
|
|
|
Химическая связь образуется за счет перекрывания АО, взаимодействующих атомов и обобществления этими атомами пары электронов с антипараллельными спинами. По правилу октетов, сформулированному Льюисом, каждый атом стремится заполнить свою оболочку до устойчивого состояния, соответствующего инертному газу. Для атома водорода это два электрона, что соответствует электронной оболочке атома гелия. Для элементов второго периода восемь электронов, что соответствует электронной оболочке атома неона. На рисунке приведены схемы образования устойчивых оболочек атомов водорода, углерода, азота и кислорода на примерах образования метана из углерода и водорода, этана из двух метильных радикалов, аммиака из азота и водорода, воды из кислорода и водорода. Стрелками указаны неподеленные электронные пара атомов азота и кислорода.
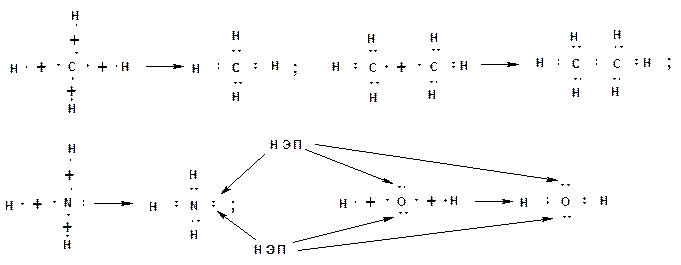
Различают два вида химической связи: электровалентная и ковалентная. Электровалентная связь осуществляется когда пара электронов полностью переходит на орбитали одного из атомов, имеющему большую электроотрицательность:
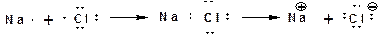
Виды ковалентной связи:
1. Собственно ковалентная связь образуется между атомами одной природы при условии равной электроотрицательности, например, между атомами углерода в молекуле этана:

2. При взаимодействии электрически нейтральной молекулы, в состав которой входит атом с НЭП, с ионом несущим положительный заряд и, соответственно, обладающим вакантной орбиталью, НЭП может переместиться на вакантную орбиталь, что приводит к образованию ковалентной связи. Образовавшаяся связь называется координационной:

На представленной схеме стрелка указывает направление смещения электронной плотности. В соответствии с особенностями электронно-дырочной проводимости, в ходе перемещения НЭП на вакантную орбиталь - положительный заряд иона водорода перетекает на атом азота.
3. Если электрически нейтральная молекула, в состав которой входит атом с НЭП, взаимодействует с электрически нейтральной молекулой, в состав которой входит атом, обладающий вакантной орбиталью, то НЭП, также как и в случае координационной связи, переходит на вакантную орбиталь. При этом образуется ковалентная связь, которая называется донорно-акцепторной:
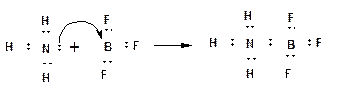
Атом, поставляющий электронную пару - называется донором. Атом, принимающий электронную пару на вакантную орбиталь - называется акцептором.
4. Ковалентная семиполярная или полуполярная связь образуется в случае переноса с орбитали атома-донора на орбиталь атома-акцептора только одного электрона (в отличие от координационной и донорно-акцепторной связей, где переносится НЭП). Например:

|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 339; Нарушение авторских прав?; Мы поможем в написании вашей работы!