
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория молекулярных орбиталей
|
|
|
|
Свойства ковалентной связи.
Ковалентная связь обладает следующими свойствами:
1. Ковалентная связь насыщенная (в отличие от электровалентной которая ненасыщенная и ненаправленная) поскольку образована парой электронов.
2. Ковалентная связь характеризуется длиной и направленностью, поскольку образующие ее орбитали занимают определенный объем вокруг атомного ядра и имеют определенную пространственную ориентацию.
3. Ковалентная связь, образованная атомами, различающимися по своей природе и электроотрицательностьи, является полярной. Электронная пара, осуществляющая связь смещается в сторону более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент.
4. Ковалентная связь обладает поляризуемостью. Это отклонение от стационарного состояния электронной плотности (пары) под действием внешних факторов. Мерой поляризуемости является молекулярная рефракция.
5. Ковалентная связь характеризуется энергией. Это энергия необходимая для разрыва связи. Поскольку после разрыва связи потенциальная энергия несвязанных атомов равна нулю, то исходная энергия связи является отрицательной величиной.
6. Химическая связь - это понижение энергии взаимодействующих атомов.
Молекулярная орбиталь это волновая функция, являющаяся решением уравнения Шреденгера.
Молекулярная орбиталь – это пространство в области взаимодействующих атомов, где велика вероятность нахождения электрона.
МО представляется как линейная комбинация АО, взаимодействующих (разных) атомов.
Для простейшей системы из двух атомов водорода. Взаимодействие двух атомов водорода может быть охарактеризовано взаимодействием двух АО, принадлежащих двум разным атомам:

АО обозначим: φ1 φ2
Линейная комбинация двух АО (φ1 и φ2)атомов водорода может быть записана двумя выражениями (суммой и разностью):
Ψ1 = а11 φ1 + а12 φ2
Ψ2 = а21 φ1 - а22 φ2
Где: аij так называемые нормировочные коэффициенты. Сумма их квадратов для каждой МО равна единице.
В результате линейной комбинации получаем две МО (Ψ1 и Ψ2). МО получается столько, сколько АО, участвовало в линейной комбинации.
Одна из МО (Ψ1 -сумма) - означает понижение энергии, по сравнению с исходными АО. Другая МО (Ψ2 -разность) – означает повышение энергии по сравнению с исходными АО (одна АО опускается, другая поднимается):
Ψ2
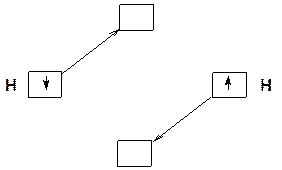
Ψ1
В соответствии с правилами заселения АО электронами заселяем электронами, взаимодействующих атомов, образовавшиеся МО:
Ψ2
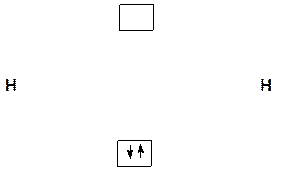
Ψ1
МО Ψ1 по энергии ниже, чем исходные АО, что приводит к понижению энергии системы взаимодействующих атомов водорода.
МО Ψ1 – сумма означает, что велика вероятность нахождения электронов, несущих отрицательный электрический заряд, в пространстве между ядрами взаимодействующих атомов водорода:
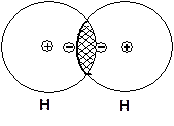
Положительно заряженные ядра атомов притягиваются к отрицательному заряду электронов, а, следовательно, и друг к другу. Чем достигается соединение атомов и образование химической связи. Поэтому МО, характеризующая концентрацию электронной плотности в пространстве между атомами - называется связующей МО.
МО Ψ2 – разность означает, на разных атомах волновая Ψ – функция имеет разный знак. Изменение знака означает, что функция имеет узловую точку, т.е. она выше по энергии чем Ψ1. Кроме того, в узловой точке волновая функция обращается в нуль. Это означает, что в пространстве, где функция обратилась в нуль вероятность нахождения электрона равна нулю. Пространство, где функция обратилась в нуль находится между реагирующими атомами. Следовательно, межатомном пространстве, на МО Ψ2, электронная плотность отсутствует. В этом случае велика вероятность нахождения электронов, несущих отрицательный электрический заряд, в пространстве за ядрами взаимодействующих атомов водорода:
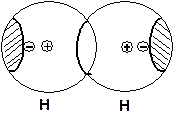
В этом случае положительно заряженные ядра атомов отталкиваются друг от друга. Чем достигается повышение энергии и разрушение химической связи. Поэтому МО, характеризующая концентрацию электронной плотности в пространстве за атомами - называется разрыхляющей МО.
Теория МО объясняет механизм образования химической связи за счет понижения энергии и концентрации электронной плотности в пространстве между атомами. Однако теория МО не объясняет особенностей в пространственном строении молекул.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 283; Нарушение авторских прав?; Мы поможем в написании вашей работы!