
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обмен нуклеопротеид0в
|
|
|
|
O
÷÷
R-СН2— СН2— СН2—С~S—КоА
½-2H, ФАД
½ O
¯ úú
R-СН2— СН= СН—С~SKоА+ФАДН2
½ +HOH
½ O
¯ ÷÷
R-СН2— СН— СН2—С~S—КоА
÷
OH
÷ -2H, НАД+
÷ O
¯ ÷÷
R-СН2— С— СН2—С~S—КоА+ НАД++H+
÷÷
O ÷ + HSКоА
O ÷ O
÷÷ ¯ ÷÷
R-СН2— С ~S—КоA+ СН3— С ~S—КоА
Ацилкофермента А Ацетилкофермента А
Окисление ненасыщенных жирных кислот в принципе может происходить так же, как и окисление насыщенных жирных кислот. Однако их окисление требует специального дополнительного набора ферментов. Процесс b-окисления жирных кислот происходит в митохондриях.
ОКИСЛЕНИЕ ГЛИЦЕРИНА. Началом окисления глицерина является его фосфорилирование с участием фосфотрансферазы. Донором фосфатного остатка является АТФ. В результате этой реакции образуется глицерофосфат.
CH2OH CH2OH
÷ фосфотранс- ÷
CHOH + АТФ ¾¾¾® CHOH +АДФ
÷ фераза ÷ OH
CH2OH ÷ ÷
CH2O-Р.=O
÷
OH
Глицерин Глицерофосфат
Затем глицерофосфат подвергается окислению с образованием фосфоглицеринового альдегида.
H
÷
CH2OH C=O
÷ -2 H ÷
CHOH ¾¾® CHOH +H2O
÷ OH +1/2 O2 ÷ OH
÷ ÷ ÷ ÷
CH2O ¾Р.=O CH2O ¾Р.=O
÷ ÷
OH OH
Фосфоглицериновый
альдегид
Дальнейшее окисление фосфоглицеринового альдегида осуществляется так же, как и при распаде углеводов.
ГЛАВА 9. ОБМЕН БЕЛКОВ
9.1. РОЛЬ БЕЛКОВ В ПИТАНИИ
Белки имеют особое значение в питании человека и животных. С белками связано осуществление основных проявлений жизни. Одной из важных функций белков является их пластическая рольвоспроизводства основных структурных элементов клетки. Эта функция белка незаменима и превосходит их значение как источника энергии. В организме почти нет белковых резервов, поэтому белки являются совершенно незаменимыми в ежедневном питании. Белковое голодание приводит к тяжелым расстройствам в организме. Особенно чувствителен к недостатку белка растущий организм. Для возмещения ежедневных потерь организм человека требует 11—13 граммов белка на килограмм веса
.
9.2. БАЛАНС АЗОТА И АЗОТИСТОЕ РАВНОВЕСИЕ
В связи с тем, что белки представляют собой азотосодержащие вещества, то для изучения белкового обмена большое значение имеет определение азотистого баланса, т. е. разницы между количеством азота, поступившего в организм с пищей, и количеством азота, выведенного из организма. Обычно в здоровом организме устанавливается азотистое равновесие, при котором азота выводится ровно столько, сколько его поступает с пищей.
При положительном азотистом балансе происходит задержка азота в организме, т. е. выводится азота меньше, чем его вводится. Положительный азотистый баланс характерен для молодого, интенсивно растущего организма, а также в случае беременности. При отрицательном азотистом балансе азота выводится больше, чем поступает. Это наблюдается при белковом голодании, при различных заболеваниях, связанных с усиленным распадом белка в организме.
9.3. РАСПАД БЕЛКОВ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
Распад белков происходит при участии протеолитических ферментов, расщепляющих пептидные связи. Переваривание белков начинается в желудке под влиянием ферментов желудочного сока. Основным ферментом желудочного сока является пепсин, который выделяется в неактивной форме в виде пепсиногена. Пепсиноген активируется соляной кислотой. Оптимум рН для пепсина лежит в пределах 1,5—2. В результате каталитического действия пепсина в желудке образуются пептоны, построенные из достаточно длинных полипептидов. Расщепление под влиянием пепсина может сопровождаться также появлением свободных аминокислот.
Пептоны и нерасщепленные белки поступают в кишечник, где подвергаются действию ферментов поджелудочной железы (трипсина и химотрипсина), относящихся, как и пепсин, к протеиназам. Трипсин выделяется соком поджелудочной железы в неактивной форме, в виде трипсиногена. Последний активируется ферментом эктерокиназой кишечного сока. Оптимум рН для трипсина равен 7—8. Неактивной формой химотрипсина является химотрипсиноген, который активируется трипсином.
Полипептиды, три- и дипептиды, образовавшиеся в результате действия на белки пепсина, трипсина, химотрипсина, подвергаются дальнейшему расщеплению в кишечнике под влиянием ферментов кишечного сока — пептидаз (карбоксипептидазы, аминопептидазы, дипептидаз). В результате последовательного действия всех вышеперечисленных ферментов пищеварительного тракта белковые вещества распадаются до аминокислот, которые всасываются в кровь через стенку кишечника.
9.4. КАТАБОЛИЗМ БЕЛКОВ И АМИНОКИСЛОТ В ТКАНЯХ
Наряду с синтезом в клетках тканей идет постоянный гидролитический распад белков, который осуществляется с участием протеолитических ферментов тканей – катепсинов. Катепсины относятся к классу гидролаз. По своему действию сходны с пепсином, трипсином и пептидазами. Внутриклеточный распад аминокислот не использованных для синтеза белка, в основном происходит путем дезаминирования и декарбоксилирования.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ.
Этот процесс заключается в отщеплении аминогруппы от аминокислоты в виде аммиака. Существует несколько путей дезаминирования: восстановительное, окислительное, гидролитическое и внутримолекулярное.
Основным путём дезаминирования является окислительное дезаминирование, суммарное уравнение которого выглядит так:
1/ 2 O2
R—CH—СOOH + ¾¾® R¾C¾- СOOH +NH3
ô ôô
NH2 O
Аминокислота Кетокислота
Окислительное дезаминирование осуществляется в две стадии. Сначала аминокислота при участии дегидрогеназ окисляется в иминокислоту.
R R
÷ НАД+(ФМН) дегидро- ÷
CH¾ NH2 ¾¾¾¾¾¾¾¾¾® C=NH+НАДН (ФМНН2)
÷ геназа, -2 H ÷
СOOH СOOH
Аминокислота Иминокислота
Водород НАДН (или ФМНН2) через переносчики перейдет на кислород, образуя воду. Вторым этапом является гидролитический распад иминокислоты на кетокислоту и аммиак.
R R
÷ ÷
C= NH + H2O ¾¾® C=O + NH3
÷ ÷
СOOH СOOH
Иминокислота Кетокислота
ОБЕЗВРЕЖИВАНИЕ АММИАКА, СИНТЕЗ МОЧЕВИНЫ.Аммиак является ядовитым веществом для живых клеток. Основной путь обезвреживания аммиака в организме связан с синтезом мочевины. Теория синтеза мочевины окончательно была сформулирована Кребсом. Однако М. В. Ненцкий и И. П. Павлов впервые обратили внимание на важнейшую роль печени в этом процессе. Сейчас доказано, что синтез мочевины в основном происходит митохондриях клеток печени в результате кругового процесса, требующего небольшого количества орнитина, получившего название орнитинового цикла.
Промежуточным продуктом этого цикла является карбамилфосфат, на синтез которого требуется две молекулы АТФ. Затем карбаминовая
ОН
карбамилфос- ½
NH3+CO2+Н2O+2АТФ——¾¾®NH2¾CO¾O~P=O+2АДФ+ НзРО4
фатсинтетаза ½
OH
Карбамилфосфат
группировка переносится с карбамилфосфата на орнитин, в результате образуется цитруллин. Последний вступает в реакцию с аспарагиновой кислотой и образует аргинин. Аргинин гидролизуется ферментом аргиназой с образованием мочевины и орнитина. Немаловажное значение в нейтрализации аммиака отводится образованию амидов - прежде всего, глютамина из глютаминовой кислоты, а также аспарагина из аспарагиновой кислоты. Синтез амидов сопряжен с распадом АТФ.
COOH CO¾NH2
÷ ÷
(CH2)2 (CH2)2
÷ Глютамин ÷
CH¾ NH2 + NH3+АТФ ¾¾® CH¾ NH2 +АДФ+H3PO4
÷ синтетаза ÷
COOH COOH
Глютаминовая Глютамин
кислота

ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ. Декарбоксилирование является весьма важным процессом диссимиляции аминокислот. Этот процесс сопровождается образованием углекислого газа и соответствующего амина.
R—CH—COOH ¾¾¾® R—CH2 + CO2
÷ ÷
NH2 NH2
Аминокислота Амин
При декарбоксилировании некоторых аминокислот образуется ряд физиологически активных веществ. Так, декарбоксилирование глютаминовой кислоты приводит к образованию g-аминомасляной кислоты, играющей большую роль в процессах торможения функции нервных клеток.
НООС—СН2—СН2—СН—СООН®НООС—СН2—СН2—СН2 +СО2
÷ ÷
NH2 NH2
Глютаминовая кислота g -Аминомасляная кислота
С.Р.Мардашев показал, что при декарбоксилировании аспарагиновой кислоты некоторыми бактериями наряду с углекислым газом образуется новая аминокислота — a-аланин.
Некоторые амины, образующиеся при декарбоксилировании аминокислот под действием микрофлоры кишечника, известны как продукты гнилостного разложения белка. Например, при декабоксилировании лизина образуется кадаверин. Аналогичным образом из диаминокислоты орнитина
-СО2
CH2—CH2—CH2—CH2—CH—COOH-® СН2—СН2—СН2-СН2-СН2
ô ô ô ô
NH2 NН2 NH2 NH2 Лизин Кадаверин
получается амин-путресцин. При декарбоксилировании триптофана образуется индолэтиламин, который при дальнейшем гнилостном распаде дает скатол и индол. Из тирозина образуется фенол и крезол.
Скатол, индол, фенол, крезол являются ядовитыми вещества. Их обезвреживание происходит в печени путем образования неядовитых парных соединений с серной кислотой или с глюкуроновой кислотой. Ядовитость путресцина и кадаверина незначительна. Эти соединения выводятся с мочой в неизменном виде.
9.5. БИОХИМИЯ СИНТЕЗА АМИНОКИСЛОТ И БЕЛКОВ
СИНТЕЗ АМИНОКИСЛОТ. Синтез аминокислот в организме может осуществляться путем восстановительного аминирования
кетокислот и в результате процесса переаминирования между кето- и аминокислотами.
Восстановительное аминирование кетокислот является главным путем синтеза аминокислот и представляет собой реакцию, обратную реакции окислительного дезаминирования. Восстановительное аминирование включает в себя две стадии. Первая стадия состоит в присоединении аммиака к кетокислоте с образованием иминокислоты. Затем иминокислота восстанавливается НАДН в аминокислоту. Например:
CH3—CO—COOH+NН3+2H-®СН3—СН— COOH +Н2O
÷
NН2
Пировиноградная кислота  a-Аланин
a-Аланин
1. CH3—CO—COOH+NН3-®СН3—С— COOH +Н
ôê
NH
Иминокислота
2. CH3—C—COOH+2 Н-®СН3—СH— COOH
ôê ô
NH NH2
Особенно легко аммиак реагирует с a-кетоглютаровой кислотой, в результате чего образуется глютаминовая кислота.
Реакция переаминирования (трансаминирования) была открыта в 1937 г. отечественными учеными А.Е.Браунштейном и М.Г. Крицман. Эта реакция заключается в переносе аминогруппы с аминокислоты на кетокислоту и осуществляется с участием ферментов — аминотрансфераз, коферментом которых является фосфопиридоксаль (фосфорное производное пиридоксина — витамина B6).
На первом этапе процесса переаминирования происходит
CH3 COOH CH3 COOH
ô ô аминотранс- ÷ ÷
 |
CH- NН2 + CH2 С =О + CH2
ô ô фераза ÷ ÷
COOH CH2 COOH CH2
ô ô
С=O CH- NН2
ô ô
COOH COOH
Аланин  -Кетоглютаровая Пировино- Глютами-
-Кетоглютаровая Пировино- Глютами-
кислота градная новая
кислота кислота
перенос аминогруппы на кофермент. Второй этап состоит в переносе
аминогруппы с кофермента на соответствующую кетокислоту. Реакция протекает без промежуточного образования аммиака. Вышесказанное можно иллюстрировать примером образования глютаминовой кислоты путем реакции переаминирования.
БИОСИНТЕЗ БЕЛКА И РОЛЬ НУКЛЕИНОВЫХ КИСЛОТ В ЭТОМ ПРОЦЕССЕ.
Белки различаются между собой природой и последовательностью чередования аминокислот, входящих в их состав. Последовательность включения определенного числа аминокислот в синтезируемую полипептидную цепь осуществляется в соответствии с информацией, заложенной в ДНК. Установлена прямая связь между интенсивностью синтеза белка в клетках и тканях с содержанием в них ДНК и РНК. Экспериментально доказано, что ферментативное расщепление РНК рибонуклеазой и ДНК-дезоксирибонуклеазой подавляет или вовсе прекращает биосинтез белка.
Процесс биосинтеза белка происходит в мельчайших субклеточных структурах- рибосомах. Его можно условно разделить на три этапа. На первом этапе происходит синтез информационной РНК на ДНК и перенос ее к рибосомам (процесс транскрипции -«переписывания»). На этом этапе происходит передача информации о строении синтезируемого белка. Второй этап включает в себя активацию аминокислот, присоединение их к специфическим транспортным РНК и перенос к рибосомам (рекогниция - «узнавание»). Третий этап - собственно рибосомальный синтез белка (трансляция), который состоит в переводе нуклеотидной последовательности и-РНК в аминокислотную последовательность полипептидной цепи.
I этап. Синтез и-РНК происходит в ядре на молекуле ДНК при участии фермента РНК-полимеразы. В определенный момент нити ДНК расходятся и к одной из нитей присоединяются свободные рибонуклеозидфосфаты (АТФ, ГТФ, ЦТФ, УТФ) к соответствующим основаниям в цепочке ДНК по принципу комплементарности. В результате молекула и-РНК в точности повторяет чередование азотистых оснований ДНК и является переносчиком генетической информации. Синтезированная и-РНК выходит из ядра в цитоплазму клетки, где соединяется с рибосомальной РНК (р-рнк).
Установлено, что одна аминокислота закодирована в и-РНК сочетанием трех нуклеотидов -триплетом (кодоном). Так, триплет УУУ (три урацила) определяет включение в полипептидную цепь фенилаланина, а ГАУ (гуанин-аденин-урацил) соответствует аспарагиновой кислоте и т. д.
II этап. Вначале происходит активация аминокислот при участии АТФ и специфического фермента. В результате образуется аминоациладенилат.
АТФ + COOH—CH—R фермент АМФ~СО—СН—R+ H4 P2O7
÷ ¾¾¾¾® ÷
NH2 NH2
Аминокислота Аминоациладенилат Пирофосфат
Затем аминоацильная группа с АМФ переносится на транспорт-
тную РНК.
 |
АМФ~СО—СН—R + т-РНК т-phk~co—ch—r + АМФ
÷ ÷
NH2. - NH2
Аминоацил т-РНК
Такой комплекс т-РНК с аминокислотой переносится к рибосомам. Для каждой аминокислоты имеется своя т-РНК. В молекуле т-РНК, имеющей конформацию клеверного листа, содержится два важнейших участка. Один из них является акцептором аминоацильной группы, переносимой от аминоациладенилата. Другой участок представляет собой триплет, который выполняет функцию антикодона, т. е. является специфическим кодоном комплементарным соответствующему кодону и-РНК.
III этап - рибосомный этап синтеза белка. Молекулы т-РНК с соответствующими аминокислотами подходят к рибосоме и присоединяются своими антикодонами к соответствующим кодонам и-РНК. Образование пептидной связи происходит при участии фермента пептид-синтетазы. После каждого образования пептидной связи происходит перемещение на один триплет. По мере продвижения рибосомы вдоль и-РНК «считывается» заключенная в ней информация и синтезируются соответствующие полипептидные цепи. В дальнейшем полипептидные цепи приобретают дисульфидные и водородные мостики, что приводит к формированию вторичной и третичной структуры белка.
Синтез белка схематически изображен на рис. 16.
Нуклеопротеиды в пищеварительном тракте под действием пепсина и соляной кислоты, а также трипсина, распадаются на простой белок и нуклеиновые кислоты. В ддальнейшем белок подвергается обычным превращениям. Расщепление нуклеиновых кислот происходит в тонком кишечнике под влиянием нуклеазы и дезоксирибонуклеазы. В результате действия нуклеаз нуклеиновые кислоты, распадаются на мононуклеотиды. 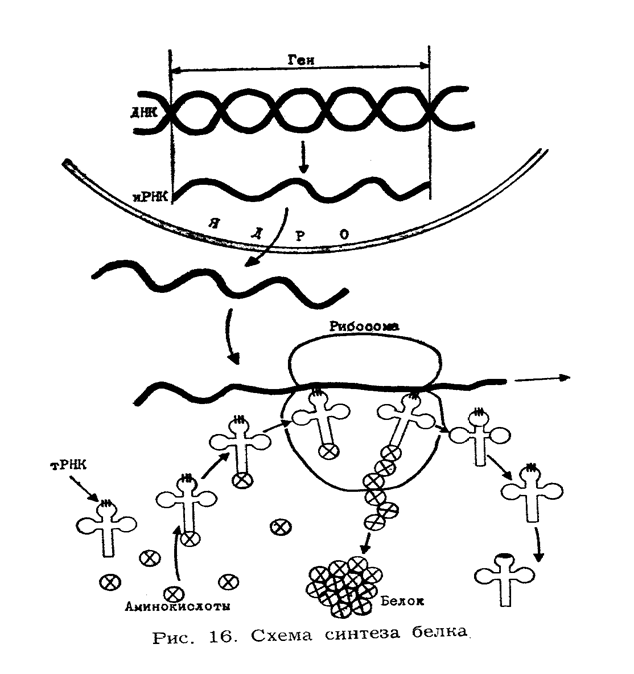 В свою очередь нуклеотиды под действием нуклеотидаз распадаются на нуклеозид и фосфорную кислоту. В виде нуклеотидов и нуклеозидов и происходит всасывание продуктов гидролиза нуклеиновых кислот.
В свою очередь нуклеотиды под действием нуклеотидаз распадаются на нуклеозид и фосфорную кислоту. В виде нуклеотидов и нуклеозидов и происходит всасывание продуктов гидролиза нуклеиновых кислот.
Нуклеиновые кислоты могут также распадаться в клетках тканей под действием тканевых нуклеаз и тканевых нуклеотидаз. Присутствующие в тканях специфические нуклеозидазы подвергают дальнейшему гидролитическому распаду нуклеозиды до пентоз и азотистых оснований.
Конечные продукты превращений пуриновых оснований у раз личных видов животных неодинаковы. У человека и человекообразных обезьян конечным продуктом обмена пуринов является мочевая кислота. Мочевая кислота поступает в кровоток и выводится почками. У большинства млекопитающих мочевая кислота d превращается в аллантоин. Пуриновые основания прежде всего подвергаются дезаминированию. При дезаминировании аденина образуется гипоксантин, который окисляется в ксантин. Гуанин превращается сразу в ксантин. Далее ксантин окисляется в мочевую кислоту, а последняя - в аллантоин. При таком распаде сохраняется пуриновое ядро.
+ H2O Гипосантин
Аденин ¾¾¾® ÷
- NH3 ÷
÷ + H2O Мочевая
+ H2O ¯ ¾¾® кислота ¾¾®Аллантоин
Гуанин ¾¾® Ксантин -2H
- NH3
Отличительной чертой распада пиримидиновых оснований в тканях многих животных является разрыв в конечном итоге пири-мидинового кольца. Конечными продуктами распада цитозина и урацила является аминокислота b-аланин и углекислый газ, а тимина - b-аминоизомасляная кислота, аммиак и углекислый газ. Продукты распада пиримидиновых оснований выводятся с мочой.
Синтез пуринового кольца сложен, хотя и идет из весьма простых веществ –CO2, глицина, аспарагиновой кислоты, муравьиной кислоты и глютамина. Наряду с этими веществами в его построение вовлекается рибозо-5-фосфат. В результате образуются не свободные пуриновые основания, а мононуклеотиды.
Исходным веществом для синтеза пиримидиновых нуклеотидов является карбамилфосфат. Последний образуется из NH3 и СО2 при участии АТФ. Далее карбамил переносится на аминогрyппу аспарагиновой кислоты, в результате чего образуется кар-бамиласпарагиновая кислота и Н3Р04. Сближение аминной и карбоксильной групп в молекуле карбамиласпарагиновой кислоты приводит к замыканию кольца с образованием дигидрооротовой кислоты. Последняя окисляется с участием флавинзависимых дегидрогеназ в оротовую кислоту.
OH
÷ -Н3РО4 -H2O
NH2-CO -O~Р.=O + Аспарагиновая ¾¾® Карбамиласпара- ¾®
÷ кислота гиновая кислота
OH
(Карбамилфосфат)
O
÷÷

 C
C
HN CH
Дигидрооротовая -2H ÷ ÷÷

 ¾® кислота ¾® O=C C-COOH
¾® кислота ¾® O=C C-COOH
NH
Оротовая кислота
Оротовая кислота является предшественником всех пиримидиновых оснований. Оротовая кислота вступает в соединение с рибозо-5-фосфатом, и образуется пиримидиновый нуклеотид оротидин-5-фосфат. Его декарбоксилирование приводит к возникновению уриди-ловой кислоты.
В основе синтеза нуклеиновых кислот (ДНК и РНК) лежат два принципа: матричный принцип и принцип комплементарности.
ГЛАВА 10. ВЗАИМОСВЯЗЬ МЕЖДУ ОБМЕНОМ БЕЛКОВ ЖИРОВ И УГЛЕВОДОВ
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!