
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Гидролизом солей называют реакции обмена между водой и растворенными в ней солями
|
|
|
|
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли в растворе появляется некоторое избыточное количество ионов H+ или ОН-, сообщающее раствору кислотные или основные свойства. Таким образом, процесс гидролиза соли во многом обратен процессу нейтрализации, т. е. процессу взаимодействия кислот с основаниями. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КС1.
11.2.1 Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH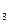 COONa Соль в растворе полностью диссоциируют на ионы:
COONa Соль в растворе полностью диссоциируют на ионы:
CH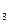 COONa
COONa CH
CH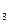 COO
COO +Na
+Na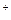 ,
,
Вода, как уже указывалось, является слабым электролитом:
H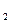 O
O H
H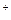 +OH
+OH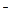 ,
,
Ионы водорода воды взаимодействуют с ацетатом-ионами с образованием слабой уксусной кислоты
CH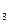 COO
COO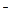 + H
+ H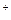
 CH
CH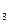 COOH,
COOH,
Таким образом, гидролиз в ионной форме можно представить уравнением
CH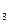 COO
COO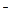 + H
+ H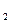 O
O CH
CH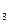 COOH +OH
COOH +OH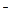 .
.
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной. Следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза, представляющая собой отношение концентрации гидролизованных молекул с гирр к исходной концентрации растворенных молекул электролита
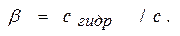 (11.3)
(11.3)
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
 ,
,
или в общем для реакции гидролиза аниона слабой кислоты
A + H
+ H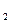 O
O HA + OH
HA + OH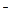 ,
,
 ,
,
Так как концентрация воды при гидролизе изменяется очень мало, то принимая ее постоянной и умножая на константу равновесия получим константу гидролиза K :
:
 ,
,
Умножая числитель и знаменатель на равновесную концентрацию ионов водорода, получим
 ,
,
Как указывалась ранее  , а отношение
, а отношение  является константой диссоциации
является константой диссоциации  слабой кислоты HA. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слакбого электролита:
слабой кислоты HA. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слакбого электролита:
 . (11.4)
. (11.4)
а степень гидролиза:
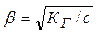 . (11.5)
. (11.5)
Как видно, степень гидролиза возрастает с уменьшением концентрации гидролизующего иона. По уравнению можно найти равновесную концентрации гинцентрацию гидроксид-иона:
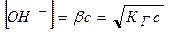 . (11.6)
. (11.6)
Отсюда легко вычисляется pH раствора соли
 . (11.7)
. (11.7)
11.2.2 Гидролиз солей, образованных сильной кислотой и слабым основанием, например 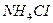 .
.
В растворе соль 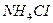 диссоциирована
диссоциирована

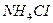

 ,
,
Гидролизу подвергается ион слабого основания, 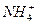
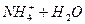
 .
.
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями и, но лишь с тем исключением, что в уравнения и входит константа диссоциации слабого основания.
Равновесную концентрацию ионов водорода можно вычислить из уравнения:
 . (11.8)
. (11.8)
Соответственно водородный показатель среды рассчитывается по уравнению
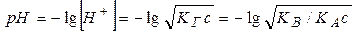 . (11.9)
. (11.9)
11.2.3 Гидролиз соли, образованной слабым основанием и слабой кислотой, например 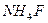
В результате гидролиза соли, образованной слабым основанием и слабой кислотой, образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания Ко, так и слабой кислоты Кк
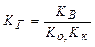 . (11.10)
. (11.10)
Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли:
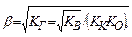 (11.11)
(11.11)

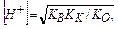 (11.12)
(11.12)
Как видно, среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Итак, при гидролизе солей, образованных слабыми кислотами или (и) основаниями, происходит подщелачивание или подкисление раствора. Степень гидролиза возрастает с разбавлением раствора и при увеличении температуры.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!