
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы. Буферные растворы – это растворы, рН (концентрация ионов водорода) которых сохраняется практически постоянной при разбавлении или при добавлении небольших
|
|
|
|
Буферные растворы – это растворы, рН (концентрация ионов водорода) которых сохраняется практически постоянной при разбавлении или при добавлении небольших количеств серной кислоты или сильного основания.
Буферным действием обладают:
1) Система слабая кислота – её соль с сильным основанием, а также сочетание кислой и средней солей слабых кислот или двух кислых солей. Примеры:
| Система | Область буферного действия |
| СН3СООН/СН3СООNa | pH: 3,8-5,8 |
| H2CO3/NaHCO3 | pH: 5,4-7,4 |
| NaHCO3/Na2CO3 | pH: 9,3-11,3 |
| NaH2PO4/Na2HPO4 | pH: 6,2-8,2 |
2) Система слабое основание – его соль с сильной кислотой:
| NH3×H2O/NH4Cl | pH: 8,2-10,2 |
3) Ионы и молекулы амфолитов – аминокислотные и белковые системы.
Буферная емкость почв:
В почвах катионы водорода, приносимые дождевой водой или образующиеся в результате жизнедеятельности, вытисняют из твердой фазы Са2+. В результате почва приобретает определенную буферную емкость – при добавлении щелочных веществ ионы Н+, связанные с твердой фазой почвы, переходят в почвенный раствор, компенсируя потери этим раствором ионов Н+ при нейтрализации щелочами. Из кислых глинистых материалов наибольшей буферной емкостью обладают минералы, монтриллонит Na0,7(Al3,3Mg0,7)(Si8O20)×nH2O.
Буферная емкость океана:
Мировой океан обладает огромной буферной емкостью, потому, что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
 H2CO3 H++HCO
H2CO3 H++HCO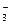 ,
,
При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
 CO2+Н2О H2CO3,
CO2+Н2О H2CO3,
При повышении кислотности происходит дополнительное растворение карбонатных пород (раковины, меловые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
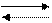 H2+CO
H2+CO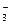 HCO
HCO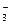 ,
,
 СаCO3 Са2++CO
СаCO3 Са2++CO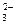 .
.
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует “парниковому эффекту” – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли.
Буферная емкость измеряется количеством кислоты или щелочи (моль или моль эквивалентов), добавление которого к 1л буферного раствора изменяет рН на единицу.
Механизм буферного действия хорошо описан в рекомендованной литературе [1], поэтому приведем только готовые формулы для расчета рН:
Для кислотного буфера рН=рKкисл + l g[соль]/[кислота], (11.13)
Для основного буфера рН=14-рKосн - lg[соль]/[основание], (11.14)
где pKкисл и рKосн – соответственно отрицательные десятичные логарифмы констант диссоциации слабой кислоты и слабого основания.
Кислотно – основными индикаторами называют вещества, меняющие свою окраску в определенной области рН раствора: лакмус (рН = 6-8), фенолфтаилин (рН = 8,2-10), метиловый оранжевый (рН = 4,2-6,3).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 585; Нарушение авторских прав?; Мы поможем в написании вашей работы!