
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектры испускания
|
|
|
|
СТРОЕНИЕ АТОМА
Количественные спектральные данные – один из основных источников информации о внутреннем строении вещества. Все виды излучений – радио, микроволновое, тепловое или инфракрасное (ИК), видимое, ультрафиолетовое (УФ), рентгеновское и гамма – являются различными проявлениями одного и того же электромагнитного излучения. Характеристиками излучения (волнового процесса) являются: амплитуда (А), длина волны (l), частота излучения (n) и скорость (с) (рис. 1.1).
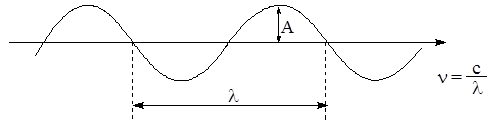
Рис. 1.1. Характеристики волнового процесса
 Электромагнитное излучение распространяется со скоростью света (С»300000 км/с). Для характеристики волнового процесса (излучения) широко используется так называемое волновое число (ν), равное величине, обратной длине волны:
Электромагнитное излучение распространяется со скоростью света (С»300000 км/с). Для характеристики волнового процесса (излучения) широко используется так называемое волновое число (ν), равное величине, обратной длине волны:

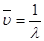
Отсюда ясен физический смысл волнового числа – число длин волн, укладывающихся на единице длины. На рис. 1.2 в логарифмической шкале представлен спектр электромагнитного излучения (длина волны выражена в см).
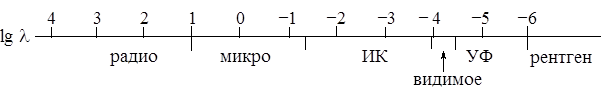
Рис. 1.2. Спектр электромагнитного излучения
Атомы в возбужденном состоянии испускают или поглощают излучение определённых длин волн; атом каждого элемента имеет свой индивидуальный спектр, позволяющий качественно и количественно идентифицировать этот атом.
Для атомного (элементного) анализа наиболее часто используют спектры испускания. Изучаемое вещество вводят в источник энергии, где вещество диссоциирует на атомы, переходящие в возбужденное состояние. Испускаемое ими излучение пропускается через призму и разлагается в спектр, регистрируемый, например, на фотопластинке. Для возбуждения спектра и его регистрации используют специальные приборы – спектрографы.
Спектры испускания бывают: непрерывные (раскалённые кристаллические и жидкие тела, некоторые газы), полосатые (молекулярные) и линейчатые (атомные). Использование спектральных приборов высокой разрешающей способности показывает, что полосы состоят из большого числа линий, располагающихся близко друг к другу.
Наиболее простой спектр испускания у атомарного водорода. Он состоит из набора линий, объединяемых в серии, описываемые общей формулой (И. Ридберг):
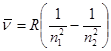 , (1.1)
, (1.1)
где R – постоянная Ридберга (не имеет никакого отношения к универсальной газовой постоянной!), равная 109677,58 см–1; n1 и n2 – целые числа (n2 > n1).
По фамилиям соответствующих исследователей эти серии получили названия:
n1=1, n2=2,3,4…, первая серия или серия Лаймана;
n1=2, n2=3,4,5…, вторая серия или серия Бальмера;
n1=3, n2=4,5,6…, третья серия или серия Пашена;
n1=4, n2=5,6,7…, четвертая серия или серия Брэккета;
n1=5, n2=6,7,8…, пятая серия или серия Пфунда.
Таким образом, число линий в спектре атомарного водорода бесконечно велико, при больших значениях n2 линии располагаются очень близко друг к другу и поэтому трудно различимы. Волновые числа линий спектральной серии могут быть выражены как разности функций целых чисел n1 и n2:
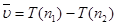 (1.2)
(1.2)
Численные значения этих функций называются спектральными термами. Для атома водорода и одноэлектронных ионов (так называемые водородоподобные частицы, например Не+, Li2+, Be3+, B4+ и т.д.) выражение для спектрального терма имеет вид:
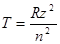 , (1.3)
, (1.3)
где z– заряд ядра частицы.
Экспериментально было установлено, что энергия излучения прямо пропорциональна частоте излучения (обратно пропорциональна длине волны). В 1900 г. немецкий исследователь Макс Планк для объяснения особенностей излучения нагретых тел выдвинул смелое предположение, что излучение испускается атомами не непрерывно (классический волновой процесс), а отдельными мельчайшими и неделимыми порциями – квантами. Величина энергии такого кванта составляет
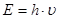 , (1.4)
, (1.4)
где h – постоянная величина, названная впоследствии постоянной Планка:
h = 6,625 · 10–27 эрг·с = 6,625 · 10–34 Дж·с.
Квант представляет собой минимальную энергию, на которую может изменяться энергия тела. Постоянная Планка – фундаментальная физическая постоянная нашего мира. Идея квантования оказалась чрезвычайно плодотворной для теории строения вещества и была в дальнейшем блестяще подтверждена многочисленными экспериментальными исследованиями.
По Планку атом излучает при переходе из состояния с энергией Е2 в состояние с энергией Е1:
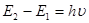 , (1.5)
, (1.5)
Согласно соотношению (1.2):
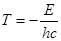 , (1.6)
, (1.6)
Для водородоподобного иона получаем:
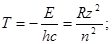
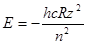 (1.7)
(1.7)
Однако классическая модель была не способна объяснить спектры испускания, в частности, почему энергия атома меняется обратно пропорционально квадрату целого числа. Нужны были новые, революционные идеи; их дал датский учёный Нильс Бор.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1048; Нарушение авторских прав?; Мы поможем в написании вашей работы!