
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория Н. Бора
|
|
|
|
Из многочисленных моделей строения атома, предложенных исследователями на рубеже XIX-XX вв., Бор использовал так называемую планетарную модель атома Эрнеста Резерфорда.
В свою очередь, названная модель была предложена Резерфордом по результатам изящных опытов по бомбардировке α–частицами (ядра атома гелия) тоненьких (около 100 атомных слоев) золотых пластинок. Исследователи, руководимые Резерфордом, установили, что практически все α–частицы беспрепятственно пролетали сквозь пластинку и лишь одна из десяти тысяч (!) не только не пролетала сквозь пластинку, но и возвращалась назад. На основе этих результатов Резерфорд сделал вывод, что атом в целом представляет собой пустотелое образование; положительно заряженное ядро, в котором сосредоточена практически вся масса атома, составляет примерно одну десятитысячную часть от атома. Вокруг ядра по круговым орбитам вращаются отрицательно заряженные электроны (аналогично планетам, вращающимся вокруг Солнца). Такая модель находилась в полном противоречии с представлениями классической электродинамики – вращающийся вокруг ядра электрон, излучая энергию, должен неизбежно упасть на ядро.
Н. Бор механически соединил классические и квантовые представления. Основные положения его теории сводятся к следующему (постулаты Бора):
1. В атоме существуют круговые орбиты, находясь на которых электрон не излучает энергию (так называемые стационарные орбиты).
2. Излучение происходит при перескоке электрона с одной стационарной орбиты на другую.
Рассмотрим математические выкладки теории Бора для водородоподобных частиц (рис. 1.3).
Сила электростатического притяжения
 (закон Кулона записан в системе СГС)
(закон Кулона записан в системе СГС)
уравновешивается центробежной силой:
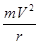 ,
,
где m – масса электрона, V – скорость движения электрона на круговой орбите.
Это первое уравнение классической механики.
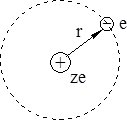
Рис. 1.3. Водородоподобный ион в теории Н. Бора
А вот второе уравнение, использованное Бором для определения радиуса орбиты электрона и его скорости, – квантовое. Н. Бор предположил, что момент импульса электрона (mVr) принимает только определённые значения:
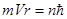 , (1.8)
, (1.8)
где n=1,2,3… – квантовое число,  .
.
Обратим внимание, что электрон в теории Бора находится в одномерном мире, где его положение характеризует единственная координата r. Если бы рассматривалась задача о движении электрона в двумерном мире, следовало бы ввести два квантовых числа. В общем случае в к -мерном мире для решения подобной задачи необходимо было бы ввести к значений параметров, названных позднее квантовыми числами.
Результатами решения системы уравнений теории Бора
 (1.9)
(1.9)
являются выражения для радиуса и скорости движения электрона:
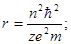
 (1.10)
(1.10)
Вычислим радиус первой боровской орбиты в атоме водорода (z=1, n=1):
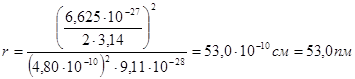
Полученное значение по порядку величины совпадает с радиусом атома, предсказываемым молекулярно-кинетической теорией (броуновское движение). Это был первый триумф теории Бора.
Энергия электрона слагается из двух составляющих – кинетической энергии 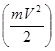 и потенциальной:
и потенциальной:
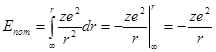 (1.11)
(1.11)
С учетом уравнения (1.11) получаем выражение для полной энергии электрона:
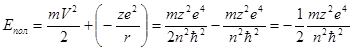 (1.12)
(1.12)
Соотношение (1.12) позволяет объяснить физическую природу линейчатых атомных спектров, даёт ключ к объяснению периодичности свойств элементов, к нему прибегают в случае оценочных расчётов.
Сопоставление соотношений (1.7) и (1.12) позволяет получить выражение для постоянной Ридберга:
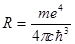 (1.13)
(1.13)
Значение, получаемое по формуле (1.13), блестяще совпадает с экспериментальной величиной. В своё время, когда Бор вычислил значение постоянной Ридберга, что называется, “на кончике пера”, это произвело впечатление чуда!
Сочетая классические и квантовые представления и будучи по этой причине внутренне противоречивой, теория Бора не способна объяснить строение и свойства многоэлектронных атомов и возможность образования межатомных связей, т. е. не способна описывать химическую связь.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 892; Нарушение авторских прав?; Мы поможем в написании вашей работы!