
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика состояния электрона в атоме системой квантовых чисел
|
|
|
|
Уравнение Шредингера (1.16) часто записывают в компактной форме:
 , (1.17)
, (1.17)
где 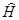 – гамильтониан, оператор энергии.
– гамильтониан, оператор энергии.
Оператор – это математический аппарат, воздействующий на Ψ-функцию с целью получения собственного значения. Например, гамильтониан – оператор полной энергии, воздействуя на Ψ-функцию, позволяет получить собственное значение полной энергии системы.
Отметим еще раз, что Ψ-функция – однозначная, конечная и непрерывная функция, имеющая нулевое значение в тех областях пространства, где нет частицы.
Решение уравнения Шредингера для атома водорода возможно лишь в полярной системе координат, где вместо декартовых координат x, y, z используются радиус-вектор и два угла (рис. 1.4).
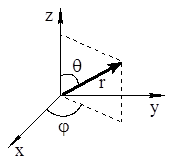
Рис. 1.4. Полярная система координат
Это решение приводит к неожиданному результату. Волновая функция электрона зависит не только от трёх координат (r, θ, φ), но и от трёх целочисленных параметров, названных квантовыми числами. Их традиционное обозначение n (как квантовое число в теории Бора), ℓ и mℓ.
В результате решения уравнения Шредингера в полярной системе координат находят волновую функцию в виде произведения:
 (1.18)
(1.18)
 ;
; 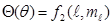 ;
; 
Выражение R(r) называется радиальной функцией распределения (радиальной составляющей волновой функции), а произведение 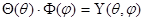 – угловой составляющей.
– угловой составляющей.
Главное квантовое число n в значительной степени определяет значение энергии электрона в атоме и размеры электронного облака. Оно принимает положительные целочисленные значения от 1 до бесконечности. С ростом n возрастают размеры электронного облака и энергия электронов. Вспомните, в теории Бора энергия электрона пропорциональна  !
!
Кроме цифрового обозначения n используется и буквенная индексация:
n = 1, 2, 3, 4 …
K, L, M, N …
Совокупность электронов, характеризующихся одним и тем же значением главного квантового числа, называют электронным слоем (школьное название – электронный уровень). Соответственно говорят о первом или K-слое, втором или L-слое, третьем или M-слое и т.д.
Второе квантовое число (ℓ), называемое орбитальным (побочным, в иностранной литературе – азимутальным) квантовым числом, характеризует энергию электрона внутри слоя (уровня) и определяет форму электронного облака. Оно принимает положительные целочисленные значения, начиная с нуля, но имеет ограничение: при данном значении главного квантового числа n величина ℓ не может превысить значение (n–1). На практике побочное квантовое число чаще обозначается буквами:
ℓ = 0, 1, 2, 3, 4,…, n–1
s, p, d, f, g,…
Совокупность электронов c одним и тем же значением побочного квантового числа называют электронной оболочкой (подуровнем). Соответственно говорят об s-, p-, d-, f- и т. д. оболочках.
Третье квантовое число (mℓ), называемое магнитным, определяет ориентацию орбитали в пространстве. Орбиталь же образуется совокупностью электронов с одним и тем же значением магнитного квантового числа, её традиционно обозначают клеточкой ٱ (квантовая ячейка). При данном значении ℓ, магнитное квантовое число принимает значения:
1, 2, 3, 4, …, ℓ
mℓ = 0
–1, –2, –3, –4, …, –ℓ
Общее число значений составляет (2ℓ+1).
Названные три квантовых числа непосредственно вытекают из решения уравнения Шредингера в трёхмерном мире. У электрона есть и четвертая квантовая характеристика – спиновое квантовое число ms, отражающее четвёртую координату нашего мира – время. Спиновое квантовое число принимает (в единицах атомного мира) лишь два значения: +½ и –½. Договоримся считать значение +½ больше значения –½ и будем обозначать электроны со спином +½ стрелочкой , а электроны со спином –½ – стрелочкой ¯.
Четыре квантовых числа есть полная и однозначная характеристика состояния электрона в атоме. Более того, в атоме не может быть двух электронов с одинаковым набором четырёх квантовых чисел (принцип Паули). Это – основной закон мира электронов. Принцип Паули позволяет рассчитать максимальное число электронов в слое, оболочке и на орбитали.



 Орбиталь характеризуется постоянным значением mℓ. Это возможно лишь при известном значении ℓ, что в свою очередь требует постоянства значения n. Таким образом, для орбитали изменяется только спиновое квантовое число, отсюда следует, что на орбитали может быть максимально два электрона и они в соответствии с принципом Паули обязательно должны иметь противоположные спины: ¯.
Орбиталь характеризуется постоянным значением mℓ. Это возможно лишь при известном значении ℓ, что в свою очередь требует постоянства значения n. Таким образом, для орбитали изменяется только спиновое квантовое число, отсюда следует, что на орбитали может быть максимально два электрона и они в соответствии с принципом Паули обязательно должны иметь противоположные спины: ¯.







 Возникает вопрос, а если на орбитали находится один электрон, то каково его состояние: или ¯? Эта проблема регулируется правилом Хунда: суммарный спин электронов оболочки должен быть максимальным. Таким образом, в рамках принятых договорённостей единственный электрон на орбитали имеет спиновое квантовое число +½.
Возникает вопрос, а если на орбитали находится один электрон, то каково его состояние: или ¯? Эта проблема регулируется правилом Хунда: суммарный спин электронов оболочки должен быть максимальным. Таким образом, в рамках принятых договорённостей единственный электрон на орбитали имеет спиновое квантовое число +½.
Оболочка характеризуется постоянным значением орбитального квантового числа, что возможно при известном значении главного квантового числа. Следовательно, для оболочки происходит изменение магнитного и спинового квантового чисел. При значении орбитального квантового числа равном ℓ число разрешённых значений магнитного квантового числа, а значит и число орбиталей в этой оболочке составляет (2ℓ+1) штук (ℓ положительных, ℓ отрицательных и ноль). Отсюда получаем, что максимальное число электронов в оболочке составит 2(2ℓ+1) или конкретно: для s-оболочки 2; для p-оболочки 6; для d-оболочки 10; для f-оболочки 14 и т.д.
Наконец, для нахождения максимального числа электронов, могущих быть в данном слое, необходимо суммировать электроны всех оболочек этого слоя. Для слоя с главным квантовым числом n это будут оболочки с ℓ =0, 1, 2, 3, …, n –1. Следовательно, ёмкость слоя составит:

Методом математической индукции легко показать, что эта сумма равна 2n2. Отсюда максимальное число электронов составит: в первом слое (К-слое) 2; во втором слое (L-слое) 8; в третьем слое (М-слое) 18 и т.д.
Энергия электрона в атоме водорода (теория Бора) определяется единственным (главным) квантовым числом, а в многоэлектронном атоме – главным и орбитальным квантовыми числами. В целом энергия электрона возрастает по мере роста суммы названных квантовых чисел при доминирующем значении главного квантового числа. При одинаковой сумме энергия состояния с меньшим значением главного квантового числа ниже. В соответствии с этими правилами энергетический ряд атомных орбиталей выглядит следующим образом:
1s < 2s < 2p < 3s< 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s <
< 4f < 5d < 6p < 7s < 5f < 6d < 7p …
Для изображения атомных орбиталей используют значения волновой функции или её квадрата (точнее угловой части этой функции). Поскольку электронная орбиталь в принципе распространяется до бесконечности, то изображают её часть (например, 80 или 90%). На рис. 1.5 представлены формы 1s-, 2p- и 3d-орбиталей.
1s-орбиталь сферически симметрична, знак соответствующей функции одинаков в разных частях системы координат. Три 2p-орбитали представляют собой объёмные гантелеобразные фигуры, прошитые соответствующими осями координат. Четыре из пяти 3d-орбиталей представляют собой двугантельные образования, различно ориентированные в пространстве. Знаки соответствующих функций для гантелей различны. Пятая 3d-орбиталь представляет собой массивную гантель, насаженную на ось z, и тороидальную катушку в плоскости xy.
Узловой поверхностью орбитали называют геометрическое место точек, где Ψ=0 (Ψ2=0). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом.
Главное квантовое число равно общему числу узловых поверхностей данной орбитали. Например, любая из 3d-орбиталей имеет одну сферическую узловую поверхность и две плоские (две конические – для  ).
).
Побочное квантовое число равно числу узловых поверхностей орбитали, проходящих через начало координат. Например, любая из пяти
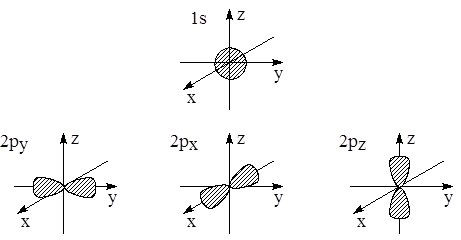

Рис. 1.5. Формы 1s, 2p и 3d-орбиталей
3d-орбиталей (ℓ=2) имеет по две узловые поверхности, проходящие через начало координат.
Отметим, что формы ns-орбиталей отличаются от формы 1s-орбитали, аналогично np-орбитали отличны от 2р-орбиталей. Однако при качественном рассмотрении вопросов химической связи, связанных с перекрыванием орбиталей, в определённом приближении можно считать любую s-орбиталь сферически симметричной, а любую р-орбиталь – гантелеподобной.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2884; Нарушение авторских прав?; Мы поможем в написании вашей работы!