
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Согласно представлениям метода ВС химическая связь в комплексных соединениях носит донорно-акцепторный характер. Свободные электронные пары, которыми обладают лиганды, заполняют пустые орбитали центрального иона. Эти орбитали объединяют в гибридные комбинации в зависимости от координационного числа (к.ч.).
Комплексные соединения с к.ч., равным двум, описываются, как правило, с позиции sp-гибридизации. Примерами являются комплексные соединения Ag (I); Cu (I); Au (I). Рассмотрим комплексный ион AgCl2–. Электронная конфигурация иона Ag+ 4d10, орбитали 5s, 5p, 5d, 5f и 5g пустые. Самые низкие по энергии из них 5s и 5p. Именно туда “селятся” две электронные пары от двух анионов хлора:
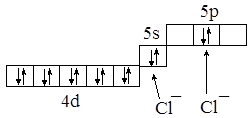
Таким образом, рассматриваемый комплекс описывается с позиции sp-гибридизации, ион серебра и два аниона хлора расположены на прямой.
Комплексные соединения с к.ч., равным трём, обычно описываются исходя из sp2-гибридизации, например, Ag(CN)32–. Три аниона CN– расположены вокруг катиона Ag+ по вершинам правильного треугольника.
В качестве примеров комплексных соединений с к.ч., равным четырём, рассмотрим два комплекса никеля (II): NiF42–; Ni(CN)42–. Электронная “макушка” иона Ni2+ – 3d8, более высокие по энергии орбитали пусты:
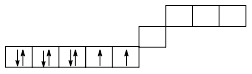
Как видно, возможны два варианта – заполнение электронными парами лигандов только пустых орбиталей и освобождение одной 3d-орбитали за счёт спаривания электронов с последующим заполнением её электронной парой лиганда, а затем – заполнение пустых орбиталей. Очевидно, всё будет определяться энергетическим балансом – выигрышем в энергии, связанным с образованием связи (Есв), и энергетическим проигрышем, равным энергии образования электронной пары из неспаренных электронов (Епары). Если Епары > Есв, то спиновое состояние центрального иона в комплексе останется тем же, что и у свободного иона. В случае, если Есв > Епары, происходит образование пары и освобождение одной орбитали в 3d-оболочке. Всё будет определяться прочностью связи лиганд–центральный ион. На практике Есв > Епары в случае только цианидных комплексов двухзарядных центральных ионов, а для комплексов с трёхзарядным ионом – комплексообразователем со следующими лигандами: CN–, NO2–, NH3.
Вернёмся к рассматриваемым комплексным ионам. Для NiF42– Епары > Есв и электронное состояние центрального иона останется неизменным:
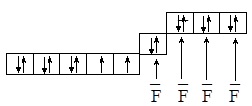
Связь в комплексном анионе характеризует sp3-гибридизация, комплексный ион имеет тетраэдрическое строение и характеризуется высоким значением спина.
Для цианидного комплексного аниона Есв > Епары, электроны “загоняются” в пару, и освободившаяся орбиталь будет занята парой электронов:
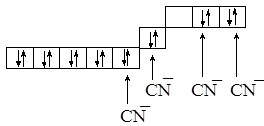
Химическую связь в этом комплексе описываем с позиций dsp2-гибридизации, комплексный анион имеет квадратное строение и характеризуется низким спином.
В связи со спиновым состоянием рассматриваемых частиц напомним, что наличие или отсутствие неспаренных электронов имеет отношение к магнитным характеристикам веществ. Ферромагнитные вещества мощно взаимодействуют с магнитным полем; это в первую очередь железо, кобальт, никель и комбинации на их основе. Парамагнитные вещества слабо реагируют на магнитное поле, фактически отзываются на него. Частицы парамагнитных веществ содержат в своём составе неспаренные электроны. Наконец, диамагнитные вещества вообще безразличны к магнитному полю. Частицы, составляющие такие вещества (атомы, молекулы, ионы), не содержат неспаренных электронов. Перечисленные выше комплексные анионы (кроме NiF42–) являются диамагнетиками. Ион NiF42– обладает парамагнитными свойствами. Парамагнетизм является основой физико-химического метода – электронного парамагнитного резонанса (ЭПР), позволяющего изучать функциональные особенности вещества.
Для описания химической связи в комплексах с к.ч., равным пяти, как правило, привлекают представления о dsp3-гибридизации. Рассмотрим в качестве примера не совсем традиционное комплексное соединение – пентакарбонил железа Fe(CO)5. Карбонилы – соединения металлов с оксидом углерода (II) могут рассматриваться, по крайней мере, в отношении химической связи, как своеобразные комплексные соединения. При этом, говоря о карбонилах и других соединениях с СО, следует иметь в виду, что это очень сильные лиганды, дающие прочную химическую связь.
Электронное строение атома железа …3d64s2. Являясь сильным лигандом, для которого Есв > Епары, СО “загоняет” указанные 8 электронов в 4 пары, находящиеся в составе 3d-оболочки, высвобождая одну из 3d-орбиталей и 4s-орбиталь:
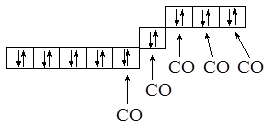
Химическая связь в молекуле Fe(CO)5 описывается с позиции dsp3-гибридизации, молекула имеет форму тригональной бипирамиды, она диамагнитна.
В качестве примеров комплексных соединений с к.ч., равным шести, рассмотрим ионы [Fe(H2O)6] 2+ и [Fe(CN)6] 4–. Центральным ионом является ион Fe 2+, имеющий конфигурацию внешнего слоя 3d 6:

Вода является лигандом, для которого Епары > Есв, поэтому для комплекса [Fe(H2O)6]2+ будет сохраняться электронная конфигурация свободного иона, свободные электронные пары от молекул воды будут последовательно занимать 4s-, 4p- и 4d-орбитали:
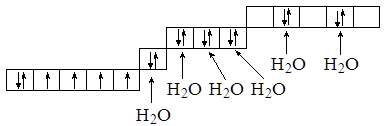
Связь характеризуется sp3d2-гибридной комбинацией орбиталей; для того, чтобы показать, что задействованы внешние d-орбитали, говорят о “внешней” гибридизации. Комплексный катион имеет октаэдрическое строение и является парамагнитным.
В случае цианидного комплекса Есв > Епары, поэтому шесть 3d-электронов займут три орбитали, а остальные две будут заполняться электронами лигандов:
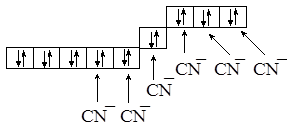
Тип гибридизации орбиталей будет таким же, что и в предыдущем случае, однако здесь задействованы внутренние d-орбитали, поэтому говорят о “внутренней” гибридизации. Комплексный анион имеет октаэдрическое строение и является диамагнитным.
|
|
Дата добавления: 2014-01-04; Просмотров: 6246; Нарушение авторских прав?; Мы поможем в написании вашей работы!