
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория кристаллического поля
|
|
|
|
Поскольку комплексообразователем является в большинстве случаев катион металла, а лигандами – анионы или сильно полярные молекулы, то электростатическое взаимодействие вносит существенный вклад в энергетику комплексообразования. Именно на этом акцентирует внимание теория кристаллического поля (ТКП). Её название отражает тот факт, что электростатическое взаимодействие характерно в первую очередь для кристаллов ионных соединений.
Основные положения теории.
1. Связь между комплексообразователем и лигандами рассматривается как электростатическая.
2. Лиганды считаются точечными ионами или точечными диполями, их электронное строение игнорируется.
3. Лиганды и комплексообразователь считаются жестко закрепленными.
4. Подробно рассматривается электронное строение комплексообразователя.
Рассмотрим наиболее распространённые октаэдрические комплексы (рис. 4.1), проанализируем взаимодействие лигандов с электронными орбиталями центрального иона (рис. 4.2 и 4.3).

Рис. 4.1. Ион-комплексообразователь в октаэдрическом поле лигандов

Рис. 4.2. Взаимодействие лигандов с s- и p-орбиталями в октаэдрическом поле

Рис. 4.3. Взаимодействие лигандов с d-орбиталями в октаэдрическом поле
Как видно из рис. 4.2 s- и p-орбитали одинаково взаимодействуют с лигандами. В случае d-орбиталей две из пяти “смотрят” прямо на лиганды, а три другие – мимо них (на рис. 4.3 приведено только сечение плоскостью zy для орбитали dzy; для орбиталей dzx и dxy аналогично). Иными словами, орбитали  взаимодействуют с лигандами сильнее, чем орбитали dzy, dzx, dxy. Следовательно, в октаэдрическом поле лигандов пять изначально одинаковых по энергии орбиталей (говорят “пятикратно вырожденный уровень”) расщепляются на две группы: орбитали
взаимодействуют с лигандами сильнее, чем орбитали dzy, dzx, dxy. Следовательно, в октаэдрическом поле лигандов пять изначально одинаковых по энергии орбиталей (говорят “пятикратно вырожденный уровень”) расщепляются на две группы: орбитали  будут иметь энергию выше, чем орбитали dzy, dzx и dxy (рис. 4.4). Величина Δокт называется энергией расщепления и является в рамках ТКП тем самым выигрышем в энергии, обуславливающим образование пар электронов или сохранение электронного состояния центрального иона в комплексе.
будут иметь энергию выше, чем орбитали dzy, dzx и dxy (рис. 4.4). Величина Δокт называется энергией расщепления и является в рамках ТКП тем самым выигрышем в энергии, обуславливающим образование пар электронов или сохранение электронного состояния центрального иона в комплексе.

Рис. 4.4. Расщепление d-уровня в октаэдрическом поле лигандов
Если Епары > Δокт, не происходит образование пар электронов и сохраняется высокоспиновое состояние. Если же Δокт > Епары, то идёт образование электронных пар и будет иметь место низкоспиновое состояние. Как уже говорилось, такое возможно только для цианидных комплексов Ме2+ и для комплексов Ме3+ с лигандами CN–, NO2–, NH3.
Если взять один и тот же центральный ион и определить энергию расщепления для его комплексов с различными лигандами, то окажется, что Δокт возрастает в следующей последовательности, называемой спектрохимическим рядом:
I– < Br– < Cl– < F– < OH– < H2O < NH3 < NO2– < CN–
Эта же последовательность сохраняется и для комплексов другого центрального иона. Лиганды левой части ряда – лиганды слабого поля, лиганды правой части ряда – лиганды сильного поля. ТКП позволяет находить количественную характеристику выигрыша в энергии связи за счёт электростатического взаимодействия – энергию стабилизации кристаллическим полем (ЭСКП). Суммарная энергия пяти d-орбиталей свободного иона составляет 5Еd; она естественно равна суммарной энергии пяти расщепленных орбиталей:
5 Еd = 2 ЕEg + 3 ЕT2g
К этому уравнению добавим очевидное равенство:
ЕEg – ЕT2g = Δокт
Решение системы двух приведенных уравнений даёт следующие результаты:
ЕEg – Еd = 3/5Δокт
Еd – ЕT2g = 2/5Δокт
Таким образом, если у иона в октаэдрическом поле на Т2g-орбиталях находится n электронов, а на Еg-орбиталях – m электронов:

Например, для рассмотренных выше комплексов [Fe(H2O)6]2+ и [Fe(CN)6] 4–:
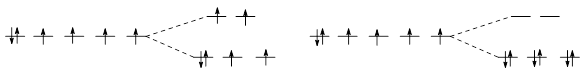
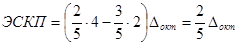

Слабое поле Сильное поле
Более прочный цианидный комплекс имеет существенно бóльшую ЭСКП.
Расщепление d-уровня центрального атома в тетраэдрическом поле лигандов приводит к понижению энергии электронов на орбиталях  (эти орбитали направлены мимо лигандов) и к её повышению на dxy, dxz и dyz-орбиталях (направлены к лигандам), как показано на рис. 4.5.
(эти орбитали направлены мимо лигандов) и к её повышению на dxy, dxz и dyz-орбиталях (направлены к лигандам), как показано на рис. 4.5.
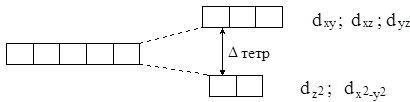
Рис. 4.5. Расщепление d-уровня в тетраэдрическом комплексе
Энергия расщепления Δтетр меньше Δокт; из чисто геометрических соображений следует, что Δтетр =  Δокт. Очевидно, что энергия стабилиза-ции кристаллическим полем в этом случае составит:
Δокт. Очевидно, что энергия стабилиза-ции кристаллическим полем в этом случае составит:
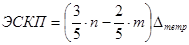
ТКП даёт простое объяснение факту наличия или отсутствия окраски у комплекса. Если возможны электронные переходы между орбиталями T2g и Eg (а это возможно при электронной конфигурации центрального иона от d1 до d9) комплексные соединения окрашены. Если же такие переходы невозможны (а это будет при электронных конфигурациях центрального иона d0 или d10) комплексные соединения бесцветны. Бесцветны комплексы серебра, меди (I), золота (I), цинка, кадмия, ртути (во всех случаях d10), алюминия, магния, скандия, лантана (во всех случаях d0). А комплексы меди (II), золота (III) уже окрашены; окрашены комплексные соединения железа (II) и (III), никеля, кобальта и т.д. В этих случаях центральные ионы имеют электронную конфигурацию dn (n=1–9).
Для объяснения химической связи в комплексных соединениях широко используется теория поля лигандов, учитывающая не только электронное строение центрального иона (атома), но и лигандов. По существу теория поля лигандов не отличается от широко используемого в квантовой химии метода МО ЛКАО.
Одноэлектронную волновую функцию молекулярной орбитали Ψ представляют в виде
Ψ = aΨo + bΦ,
Φ=C1φ1 + C2φ2 + … + Ciφi,
где Ψo – атомная орбиталь центрального иона (атома); Φ – молекулярная орбиталь системы лигандов, φi – атомная или молекулярная орбиталь i–го лиганда.
Теоретические представления показывают, что Ψ, Ψo и Φ должны обладать одинаковыми свойствами симметрии. Такие линейные комбинации атомных орбиталей системы лигандов получили название “групповых орбиталей”.
Теория метода МО предполагает, что перекрывание орбиталей Ψo и Φ в определённой степени происходит во всех случаях, когда это разрешено симметрией. В результате эта теория предусматривает как чисто электростатическое взаимодействие при отсутствии перекрывания орбиталей, так и максимальное перекрывание с минимальным вкладом электростатической составляющей взаимодействия и все промежуточные степени перекрывания.
Таким образом, теория поля лигандов является наиболее полной и общей теорией химической связи в комплексных соединениях.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6813; Нарушение авторских прав?; Мы поможем в написании вашей работы!