
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория строения атома по Н.Бору
|
|
|
|
В 1913 г. Н. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком.

3.3 - Бор (Bohr) Нильс Хенрик Давид (1885-1962)
Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями - квантами энергии.
 3.4 - Планк(Planck) Макс(1858-1947)
3.4 - Планк(Planck) Макс(1858-1947)
|
Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать.
Постулат Планка (1911): свет излучается и поглощается квантами:
E=h*n, (3.1)
где h – постоянная Планка, 6,626*10-34 Дж*с,
n=с/l, c – скорость света,
l - длина волны.
Н. Бор, используя модель Резерфорда и теорию Планка предложил модель строения атома водорода. Бор сформулировал свои постулаты:
1. Электрон в атоме находится в «стационарном» состоянии (движется по стационарной орбите) и никакой энергии не излучает.
2. Будучи выведен из стационарного состояния (переведен на другую орбиту), электрон возвращаясь, излучает квант света h*n=E2-E1.
3. Электрон в атоме может находиться только на тех «разрешенных» орбитах, для которых момент количества движения (mvr) принимает некие дискретные значения.
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
Н. Бор определил радиусы разрешенных орбит в атоме водорода:
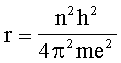 , (3.2)
, (3.2)
где n = 1,2,3,4… назвали главными квантовыми числами.
Энергия электрона на орбитах:
 . (3.3)
. (3.3)
Подставив соответсвующие константы, получим радиус первой Боровской орбиты для атома водорода r=5,29*10-13 м. Отметим, что энергия обратно пропорциональна n2. Энергия первой орбитали атома водорода по Бору равна 13,6 эВ.
|
Рисунок 3.5 - Модель атома Бор-Резерфорд
Уровни энергии разрешенных орбиталей выглядят следующим образом.
В невозбужденном состоянии электрон находится на ближайшей к ядру орбите, т.н. основное состояние. Он может быть возбужден- переброшен на более высокие, но разрешенные, орбитали, а затем вернется в основное состояние, излучая кванты света, отвечающие линейчатому спектру.
Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой - к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла.
Достижения теории Н. Бора:
Описал радиус атома водорода,
Определил энергию его ионизации,
Описал количественно спектр атома водорода.
Недостатки теории:
Не удается описать спектры многоэлектронных атомов, поведение атомов в магнитном поле.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1439; Нарушение авторских прав?; Мы поможем в написании вашей работы!