
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Э.Шредингера. Квантовые числа
|
|
|
|
Теперь все резко усложняется, поскольку электрон размазан в атоме и его движение нужно описывать как волновое, приходится вводить так называемую волновую функцию y(x,y,z), описывающую движение электрона как волны. Чтобы описать положение электрона в атоме необходимо найти, хотя бы приблизительно, где можно обнаружить этот размазанный электрон, т.е. определить наиболее вероятный радиус орбиты, определить его энергию и т.о. описать спектры атомов.
Вероятность нахождения электрона в заданной точке пространства и его энергии описываются волновой функцией. Волновая функция для данного электрон также, называется орбитальной волновой функцией. Область пространства, где в данный момент электрон может находиться с достаточно высокой вероятностью, называется орбиталью.
Согласно определению В.И. Пупышева, орбиталь – функция декартовых координат электрона, т.е. вектора с координатами x,y,z, не имеющая самостоятельного физического смысла. Смысл имеет лишь y2 (а если волновая функция комплексна, то квадрат ее модуля), определяющий вероятность найти электрон в данной области пространства.
В 1926г. Эрвин Шредингер предложил уравнение, получившее название волнового уравнения Шредингера.
 , (3.9)
, (3.9)
где U – потенциальная энергия электрона;
E – полная энергия электрона,
y сумма вторых производных волновой функции по осям координат x,y,z;
m – масса электрона,
h – постоянная Планка.
Это уравнение связывает волновую функцию y с потенциальной энергией электрона U и его полной энергией E,
Для описания положения и энергии электрона в атоме используется четыре квантовых числа. Эти числа можно рассматривать как некие коэффициенты в решениях важнейшего в квантовой механике уравнения Шредингера.
Главное квантовое число n эквивалентно квантовому числу в теории Бора. Оно в основном определяет энергию электронов на данной орбитали:
En =-(2p2me4Z2)/(n2h2) =-13,6 эВ*Z2/n2,
где Z – заряд ядра, допустимые значения n = 1(K), 2(L), 3(M), 4(N), 5(O)…
Орбитальное квантовое число l определяет значение орбитального момента количества движения электрона на данной орбитали (характеризует форму орбитали).
 , (3.10)
, (3.10)
допустимые значения l = 0, 1, 2, 3 …, n-1
Исторически первые четыре значения орбитального квантового числа l имеют буквенные символы, произошедшие от спектроскопических терминов, использованных в 1890-е годы при описании спектров щелочных металлов: 0 – s (sharp – резкий), 1 – p (principal – главный), 2 – d (diffuse – диффузный), 3 – f (fundamental – фундаментальный). Изображаемые в учебниках «формы» орбиталей представляют собой графики функций, изображающие области математического пространства, где нахождение электрона данной орбитали наиболее вероятно. Эта область определяется квадратом соответствующей волновой функции.
| n=1 | l=0 | m=0 | 1s |
| n=2 | l=0 | m=0 | 2s |
| l=1 | m=-1,0,1 | 2px, 2py,2pz | |
| n=3 | l=0 | m=0 | 3s |
| l=1 | m=-1,0,1 | 3px,3py,3pz | |
| l=2 | m=±2,±1,0 | 3dxy,yz,xz, 
| |
| n=4 | l=0 | m=0 | 4s |
| l=1 | m=-1,0,1 | 4px,4py,4pz | |
| l=2 | m=±2,±1,0 | 4d | |
| l=3 | m=±3, ±2, ±1,0 | 4f (7 орбиталей) |
А вот так выглядят s,p,d-орбитали
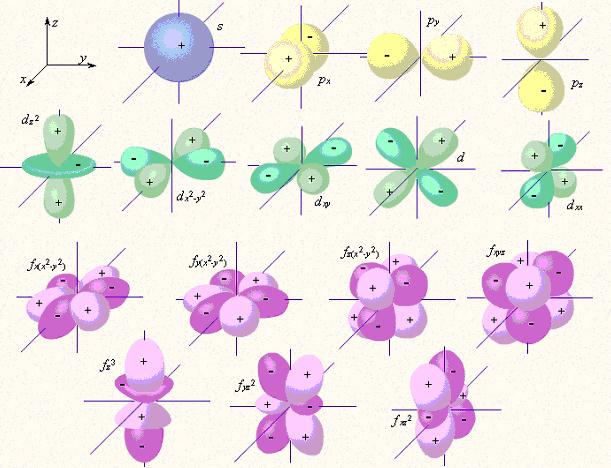
|
| Рисунок 3.6 -Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей |
Магнитное квантовое число ml определяет значение составляющей проекции момента количества движения электрона на выделенное направление в пространстве: ml (h/2p) (характеризует ориентацию орбиталей в пространстве). В отсутствие внешнего магнитного поля электроны на орбиталях с одинаковым значением орбитального квантового числа l энергетически равноценны (т.е. их энергетические уровни вырождены). Однако в постоянном магнитном поле некоторые спектральные линии расщепляются. Это означает, что электроны становятся энергетически неравноценными. Например, p-состояния в магнитном поле принимают 3 значения вместо одного, d-состояния – 5 значений. Mz = h*ml/2p. Допустимые значения ml для данного l: -l…,0,…+l
Спиновое квантовое число ms связано с наличием собственного магнитного момента у электрона. В общем виде выражение для магнитного момента количества движения совпадает с таковым для орбитального момента: Ms = [ms(ms+1)]1/2h/2p. Для электрона ms принимает только два значения: +1/2 и -1/2. Иногда для более наглядного объяснения понятия спина используют грубую аналогию – электрон представляют как летящий волчок (круговой ток, создающий собственное магнитное поле). Такая аналогия позволяет объяснить наличие спина +1/2 у электрона и протона, но не у нейтрона – частицы с нулевым зарядом. Электроны с разными спинами обозначаются ¯.
Понятие «спин» не укладывается в наши «макропредставления» о пространстве. При всех способах его регистрации спин всегда направлен вдоль той оси, которую наблюдатель выбрал за исходную. Значение спина 1/2 означает, что электрон (протон, нейтрон) становится идентичным сам себе при обороте на 720о,а не 360о, как в нашем трехмерном мире.
Рассмотренные выше квантовые числа могут показаться понятиями абстрактными и далекими от химии. Действительно, пользоваться ими для расчетов строения реальных атомов и молекул можно только при наличии специальной математической подготовки и мощной ЭВМ. Однако, если добавить к схематично изложенным понятиям квантовой механики еще один принцип, квантовые числа «оживают» для химиков.
И так, электрон в атоме характеризуется:
1. Главным квантовым числом n, указывающим на энергию электрона;
2. Орбитальным квантовым числом l, указывающим на характер орбиты;
3. Магнитным квантовым числом, характеризующим положение облаков в пространстве;
4. И спиновым квантовым числом, характеризующим веретенообразное движение электрона вокруг своей оси.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3990; Нарушение авторских прав?; Мы поможем в написании вашей работы!