
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хід уроку
|
|
|
|
Урок № 7
Тема: Ядерна модель атома.
Мета: 1) дати учням уявлення про будову атома; познайомити їх із планетарною моделлю атома за Резерфордом; розкрити шляхи виходу з кризи класичної фізики; пояснити квантовий характер випромінювання та поглинання світла атомом і закономірності в лінійчастому спектрі атома Гідрогену.
2) формувати навички абстрактного мислення під час пояснення моделі атома;
3) розвивати вміння креслити моделі атомів.
Обладнання: Таблиця «Періодична система хімічних елементів Менделєєва», Відеофільм «Дослід Резерфорда»
І.Актуалізація опорних знань: (5хв)
ІІ. Мотивація навчальної діяльності: (5хв)
Відеофільм «Дослід Резерфорда»
ІІІ. Вивчення нового матеріалу: (50хв)
1. Модель атома Томсона. До 1902 року було здійснено достатньо експериментів, які переконливо довели, що електрон є однією з основних складових частий будь-якої речовини.
Дж. Дж. Томсон показав на основі класичної електромагнітної теорії, що розміри електрона мають бути порядку 10-15 м. Крім того, було відомо, що розміри атома становлять кілька ангстрем (один ангстрем дорівнює 10-10 м). На цій підставі Томсон 1903 року запропонував свою модель атома, відповідно до якої атоми являють собою однорідні кулі з позитивно зарядженої речовини, у якій містяться електрони (рис. 142). Сумарний заряд електронів дорівнює позитивному зарядові атома. Тому атом у цілому електрично нейтральний.

Рис. 142
Ця модель дістала назву «пудинг», оскільки електрони були вкраплені в позитивно заряджене середовище, немов ізюм у пудинг.
Відхилення електрона в атомі від положення рівноваги приводить до виникнення повертаючої сили. А отже, електрон, виведений яким-небудь способом із положення рівноваги, здійснює коливання й тому є джерелом електромагнітного випромінювання.
Модель Томсона здавалася привабливою з тієї точки зору, що передбачала наявність електронів в атомі. Однак вона проіснувала тільки до 1911 року.
2. Досліди Резерфорда. У 1911році Е. Резерфорд запропонував своїм співробітникам ( жсперимеїггально перевірити переконливість моделі атома Томсона. Ідея досліду була проста. Якщо модель атома Томсона відповідає дійсності, то експериментатори, пропускаючи крізь дуже тонку металеву плівку вузький пучок швидких α -частинок, не повинні виявити скільки-небудь помітного відхилення цих частинок.
Резерфорд установив, що кожна α-частинка, потрапляючи на екран із сірчистого цинку, викликає спалах світла. Зазнавши розсіювання в золотій фользі, α -частинки вдарялися потім в екран і реєструвалися за допомогою мікроскопа.
Очікувалося, що пучок α -частинок під час проходження крізь тонку фольгу злегка розсіюється на невеликі кути. Це дійсно спостерігалося. Але несподівано з'ясувалося, що приблизно одна α -частинка з 20 000, які падають на золоту фольгу завтовшки усього лише 4 · 10-5 см, повертається назад у бік джерела.

Рис. 143
Резерфордові знадобилося кілька років, щоб остаточно зрозуміти таке несподіване розсіювання а-частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об'ємі в центрі атома, а не розподілений по всьому атому, як у моделі Томсона.
3. Ядерна модель атома Резерфорда. Резерфорд запропонував ядерну («планетарну») модель атома:
1)атоми будь-якого елемента складаються з позитивно зарядженої частинки, що дістала назву ядра;
2)до складу ядра входять позитивно заряджені елементарні частинки — протони (пізніше було встановлено, що й нейтральні нейтрони);
3)навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
Користуючись схемою (рис. 143), можна пояснити спочатку будову атома Гідрогену, що має тільки один протон і один електрон. Потім розглядаємо ядерну модель будови більш складних атомів — Гелію й Літію. Як вправа може бути розглянута будова атомів низки більш складних елементів.
Необхідно зазначити, що атом, який утратив (чи набув) один або кілька електронів, уже не буде нейтральним, а матиме позитивний (або негативний) заряд. Його називають позитивним (або негативним) іоном.
4. Непереконливість класичної теорії в поясненні випромінювання та поглинання енергії атомом. За всієї переконливості планетарної моделі виникла ціла низка нездоланних перешкод під час пояснення будови атома. Відповідно до класичної теорії, система, що складається з масивного позитивно зарядженого ядра та легких, негативно заряджених електронів, буде стійкою тільки в тому випадку, коли електрони перебувають у русі. Таким чином, атом має бути подібний до мініатюрної Сонячної системи, у якій роль Сонця відіграє ядро, а планет — електрони.
Аналогія була б досить повною (адже електричні й гравітаційні сили залежать від відстані, як 1/ r 2), якби не один прогноз класичної теорії. Відповідно до нього електричні заряди, які прискорено рухаються, мають випромінювати енергію у вигляді електромагнітних хвиль. Тому електрони, які рухаються по «планетарних» орбітах, мали б шляхом випромінювання втрачати енергію руху й у результаті швидко наближатися до ядра. Розрахунки показували, що електрон в атомі Гідрогену мав би випроменити всю свою енергію за малу частку секунди. Однак в атомі цього не стається.
Більш того, спектральні лінії, відповідно до класичних уявлейь, не повинні існувати, а має бути тільки неперервний спектр.
Отже, на початку XX століття серед довжелезної низки нерозв'язаних проблем фізики атома однією з найбільш гострих було пояснення оптичних спектрів атома. Теорія атома мала визначити положення кожної спектральної лінії в спектрах усіх елементів.
У 1885 році швейцарський фізик І. Бальмер довів, що всі частоти видимої частини спектра випромінювання атома Гідрогену можуть бути обчислені за дуже простою формулою (серія Бальмера):
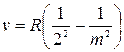 ,
,
де-R — величина стала, а m = 3, 4, 5,..., ∞.
Пізніше, 1906 року, англійським фізиком Лайманом була відкрита серія ліній в ультрафіолетовій частині спектра Гідрогену (серія Лаймана):
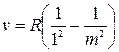 .
.
У 1908 році німецьким фізиком Пашеном була відкрита серія ліній в інфрачервоній частині спектра Гідрогену (серія Пашена):
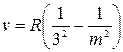 .
.
Отже, частоту будь-якої лінії в спектрі атома Гідрогену можна подати у вигляді:
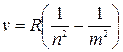 .
.
Із цієї формули видно, що в спектральних закономірностях особливо важливу роль відіграють цілі числа т і п, так звані головні квантові числа.
Усі наведені вище формули є чисто емпіричними. Пояснити лінійчастий спектр випромінювання атомів Гідрогену вдалося лише після створення 1913 року Н. Бором квантової теорії будови атома Гідрогену.
5. Квантові постулати Бора. В основі теорії Бора лежать такі положення:
• у стійкому атомі електрон може рухатися лише по особливих, стаціонарних орбітах, не випромінюючи при цьому електромагнітної енергії;
• атом може переходити з одного стаціонарного стану до іншого. Під час переходу атома зі стаціонарного стану з більшою енергією до стану з меншою енергією атом випромінює квант енергії, якому відповідає частота
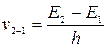 ;
;
• у стаціонарному стані атома електрон, рухаючись по коловій орбіті, повинен мати дискретні, квантові значення моменту імпульсу 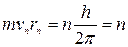 ħ, де п = 1, 2, 3 — номер орбіти; r — радіус орбіти:
ħ, де п = 1, 2, 3 — номер орбіти; r — радіус орбіти:
 .
.
Постулати Бора пояснюють походження лінійчастих спектрів і їх закономірності.
Перший постулат називається постулатом стаціонарних станів. Цей постулат суперечить класичній механіці та електродинаміці Максвелла.
Другий постулат називається правилом частот. Якщо електрон перескакує на іншу орбіту, де його енергія менша, то куди дівається надлишок енергії? Адже зникнути, перетворитися на ніщо енергія не може. «Шукайте її поза атомом!» — заявляє Бор. Вона виділяється з атома у вигляді кванта світлової енергії (поняття про який було уведено Планком), а електрон, який випроменив, рухається по орбіті, тепер вже іншій, і знову не випромінює.
Третій постулат називається правилом квантування орбіт. Виявилося, що можна одержати низку дискретних розділених стаціонарних станів тільки за того припущення, що момент імпульсу електрона квантується. Звідси дістаємо вираз для радіусів орбіт:
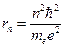 ,
,
де те й е — маса та заряд електрона.
Фізики до появи теорії Бора не могли розшифрувати складні спектри. Коли ж Бор довів, що «спектр — це біографія атомів, точніше атомних електронів», учені змогли, комбінуючи різні орбіти електронів в атомі, обчислити всі лінії, що спостерігаються у спектрі. Таким чином, джерелом світла є збуджений атом, світло генерується під час переходу атома з одного збудженого стану в інший, частота світла, що генерується, пропорційна ΔЕ, світло випромінюється й поглинається у вигляді квантів.
Слід звернути увагу учнів на половинчастість теорії Бора, її внутрішню суперечливість. У ній поряд із законами класичної фізики (закони Ньютона й Кулона, формули кінетичної й потенціальної енергій) уводяться квантові постулати, які зовсім не випливають із законів класичної фізики. Тому теорія Вора змогла пояснити закономірності будови тільки найпростішого атома — атома Гідрогену. Пояснити ж закономірності будови складних атомів вдалося тільки після створення більш послідовної теорії — квантової механіки й квантової електродинаміки.
6.Експериментальне підтвердження постулатів Бора. Ідеї Н.Бора були підтверджені експериментально 1913року в досліді Д. Франка та Г. Герца. Ідея цього досліду полягала у вимірюванні кількості енергії, що передається атомом під час зіткнення з електроном.
Із досліду Франка й Герца випливає, що енергія атома може мати лише дискретні значення Е 1, Е 2, Е 3,..., Еп, де Е 1 — енергія нормального (не-збудженого) стану атома.
7.Енергія атома Гідрогену. Повну енергію атома Е можна подати у вигляді суми кінетичних енергій електрона й атомного ядра та потенціальної енергії їх взаємодії. Будемо вважати ядро нерухомим. Тоді в енергію атома ввійде тільки кінетична енергія електрона  і потенціальна енергія кулонівської взаємодії
і потенціальна енергія кулонівської взаємодії 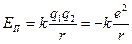 .
.
Таким чином  .
.
Ми бачимо, що енергія атома від'ємна й зі збільшенням радіуса орбіти r зростає. Визначимо радіус орбіти в атомі Гідрогену.
Оскільки кулонівська сила надає електронові доцентрового прискорення а = υ2r, то за другим законом Ньютона 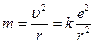 .
.
Із третього постулату Бора mυnrn = nħ швидкість, з якою рухається електрон по орбіті, дорівнює 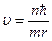 . Застосовуючи ці формули, дістаємо радіус орбіти:
. Застосовуючи ці формули, дістаємо радіус орбіти: 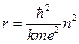 .
.
Здобута формула показує, що радіуси стаціонарних орбіт мають дискретні значення, пропорційні квадратові цілого числа п. В основному (не-збудженому) стані (п = 1 ) атом має мінімальні розміри r 1 = 0,53·10-10 м. Підчас переходу атома в збуджені стани (п = 2, 3,...) його радіус збільшується за законом r = r 1 п2.
Підставляючи вираз для радіуса орбіти до формули для енергії, остаточно дістаємо:
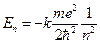 .
.
Повна енергія атома є величиною від'ємною, і тільки у разі іонізації повна енергія атома дорівнює нулю. Це рівносильно твердженню: у нормальному стані атом має мінімальну енергію, а у разі іонізації — максимум, енергії, яка дорівнює нулю.
Для атома Гідрогену енергія іонізації дорівнює 13,6 еВ. Оскільки  , то
, то 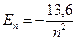 . Для незбудженого стану при п = 1 Е 1 = -13,6 еВ; при п = 2 Е 2 = -3,4еВ; при n = 3 E 3 = -1,5еВ; при п = ∞ Е = 0.
. Для незбудженого стану при п = 1 Е 1 = -13,6 еВ; при п = 2 Е 2 = -3,4еВ; при n = 3 E 3 = -1,5еВ; при п = ∞ Е = 0.
8. Спектр випромінювання атома Гідрогену. Відповідно до другого постулату Бора, випромінювання відбувається під час переходу атома з верхніх енергетичних рівнів на нижні.
Випромінювані при цьому фотони будуть мати частоти, які визначаються формулою: 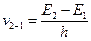 .
.
Переходи в перший збуджений стан із верхніх рівнів утворюють серію Бальмера, що спостерігається у видимому світлі. На рис. 144 показані серії випромінювання атома Гідрогену в різних діапазонах.
Під час випускання світла атом може переходити з будь-якого стану в незбуджений відразу, наприклад, Е 5 – Е 1, = hv 5,1, або послідовно, через проміжні стани:
E 5 - E 4 = hv 5, 4
E 4 - E 3 = hv4, 3
E 3 - E 2 = hv 3, 2
E 2 – E 1 = hv 2, 1
Усі ці переходи здійснюються відповідно до закону збереження й перетворення енергії: hv 5, 1 = hv 5, 4 + hv 4, 3 + hv 3, 2 + hv 2, 1.
ІV. Закріплення нового матеріалу: (10хв)
Якісні вправи
V. Домашнє завдання:
Вивчити конспект, задачі.

б) переходи між енергетичними рівнями.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1494; Нарушение авторских прав?; Мы поможем в написании вашей работы!