
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критерии самопроизвольного протекания химического процесса. Энергия Гиббса
|
|
|
|
Итак, имеем два критерия возможности самопроизвольного протекания химического процесса – изменение энтальпии DН, которое отражает взаимодействие атомов, образование химических связей, то есть определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, то есть критерий процесса – уменьшение энтальпии или DН<0.
Если DН=0, то критерий самопроизвольного протекания процесса DS>0.
Чтобы иметь возможность количественно сопоставить эти два критерия, нужно, чтобы они выражались в одинаковых единицах (DН – кДж, DS – Дж/К). Очевидно, чтобы выразить энтропийный фактор в единицах энергии, его нужно домножить на температуру. Это тем более логично, что повышение Т способствует увеличению беспорядка в системе. Тогда ТDS – энтропийный фактор процесса, DН – энтальпийный. В состоянии равновесия оба этих фактора должны быть равны:
DН= ТDS. (8.12)
Это уравнение универсально, оно относится и к равновесию жидкость – пар и к другим фазовым превращениям, а также к химическим реакциям. Благодаря этому равенству можно рассчитать изменение энтропии в равновесном процессе, так как при равновесии:
DН/Т = DS.
Однако нас интересует количественный критерий принципиальной возможности протекания процесса. В механике критерий падения тела это уменьшение его гравитационного потенциала, который не зависит от пути перемещения тела. По аналогии химический процесс можно охарактеризовать своим потенциалом, который должен уменьшаться в ходе самопроизвольного процесса. Этот потенциал при постоянной температуре и давлении принято называть изобарно – изотермическим потенциалом Гиббса G. Убыль этого потенциала не зависит от пути процесса и равна максимальной работе, которую можно получить, переходя от данного состояния к равновесному (за вычетом работы против внешнего давления).
-DG=Wрmax. (8.13)
То есть энергия Гиббса – это часть энергетического эффекта химической реакции, которую можно превратить в работу, ее называют свободной энергией.
В таком случае условием возможности протекания процесса будет DG<0, но поскольку в состоянии равновесия DG=0, то из уравнения (1) получаем:
DG=DН - ТDS, (8.14)
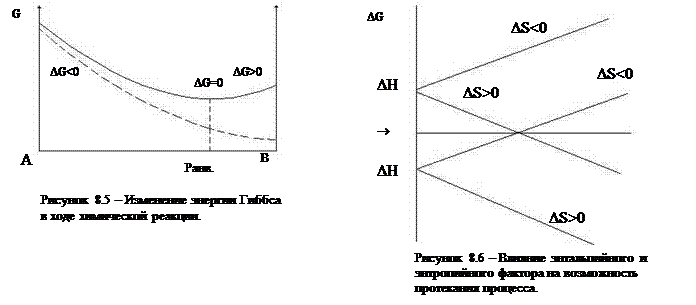
Таким образом, мы определяем G=Н – ТS и можем нарисовать его изменение в ходе процесса (рисунок 8.5):
А«В,
где А – исходные вещества;
В – продукты реакции.
В левой части графика (8.5) – уменьшение значения G, идет прямая реакция. Для нее DG<0. Справа от положения равновесия идет обратная реакция, для нее DG<0. В состоянии равновесия DG=0.
Как влияют величины энтальпийного и энтропийного фактора на протекание процесса?
DG=DН - ТDS
Возможны следующие случаи (рисунок 8.6):
1) экзотермическая реакция, DН<0:
а) DS>0, тогда для любого Т DG будет меньше нуля и процесс идет всегда, причем до конца;
б) DS<0, в этом случае все будет зависеть от соотношения абсолютных значений энтальпийного и энтропийного фактора, DG<0 – реакция идет, DG>0 – реакция не идет.
Экзотермические реакции, сопровождаются уменьшением энтропии, идут при низких температурах, увеличение Т способствует протеканию обратной реакции (Принцип Ле Шателье).
2) Эндотермическая реакция, DН>0:
а) DS>0, реакция возможна только если | ТDS|>|DН|, тогда DG>0, то есть при высоких температурах;
б) если же, DS<0, то DG>0 при любых температурах и процесс самопроизвольно идти не может.
Пример – реакция окисления глюкозы до CO2 и H2O:
С6Н12О6 + 6О2 ®6СО2 + 6Н2О DН= - 2810 кДж.
Энтропия при этом, очевидно, возрастает. Следовательно, обратный процесс принципиально не может идти самопроизвольно. Для его протекания требуется энергия извне (фотосинтез).
Следует отметить, что в вопросе о возможности протекания процесса термодинамический критерий – истина в последней инстанции. Если изменение значения энергии Гиббса положительные DG>0, никакие катализаторы не помогут провести процесс. При изменении значения энергии Гиббса отрицательные DG<0 процесс может быть заморожен.
До сих пор рассматривали процессы, протекающие при постоянном давлении. Если обратиться к процессам, протекающим при постоянном объеме, получим другое значение термодинамического потенциала – потенциал Гельмгольца:
DF = DU - ТDS, (8.15)
Для решения вопроса о возможности протекания процесса, для расчетов энергии Гиббса DG необходимо установить, от чего она зависит и стандартизировать ее.
Значении DН зависит от температуры и давления и в первом приближении мы считаем, что эта зависимость незначительна и пользуемся стандартными значениями DН°. значение DS кроме давления и температуры зависит еще от концентрации (S=S° - RlnC), следовательно, значение DG также будет зависеть от концентрации реагирующих веществ, а они в ходе процесса меняются. Рассмотрим эту зависимость.
аА®bВ (для простоты)
DG=DН - ТDS, как для всякой реакции.
Считая, что DН слабо зависит от Т, DН = DН° = bDН°f(B) - aDН°f(A),
DS = bS(B) – aS(A) = b(S°B – Rln(B)) – a(S°A – Rln(A)),
Перегруппировав и вспомнив свойства логарифмов получим:
DS= S° - Rln(Bb/Aa),
Подставив в уравнение для DG, получим
DG=DН° - ТDS° + Rln(Bb/Aa) = DG + RTln(Bb/Aa), (8.16)
Это уравнение изотермы Вант-Гоффа.
где DG°=DН° - ТDS° - термодинамический потенциал, определенный для единичных концентраций или для чистых веществ, то есть стандартный термодинамический потенциал - он определен для единичных концентраций начальных и конечных веществ и для общего давления 1 атм, но может быть разным для разных температур.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3634; Нарушение авторских прав?; Мы поможем в написании вашей работы!