
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
|
|
|
|
Скорость химической реакции (v) определяется изменением молярной концентрации реагирующих веществ в единицу времени:
v = 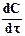
где v - скорость реакции, С - молярная концентрация реагирующих веществ, t - время.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции (температуры, концентрации, присутствия катализатора и т.д.)
Влияние концентрации. Чтобы две молекулы прореагировали, необходимо, чтобы они столкнулись. Лишь небольшая часть столкновений является эффективной, то есть ведет к реакции. Число эффективных столкновений пропорционально общему числу столкновений, а значит и концентрации реагирующих веществ.
Закон скоростей. В случае простых реакций скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятые в степенях, равных их стехиометрическим коэффициентам.
Для реакции mA + nB 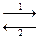 pC + qD,
pC + qD,
где 1 и 2 соответственно направление прямой и обратной реакции, имеем:
v1 = k1´[A]m´[B]n
v2 = k2´[C]p´[D]q,
где v - скорость реакции, k - константа скорости, [А] - молярная концентрация вещества А.
Константа скорости k численно равна скорости реакции, если концентрации реагирующих веществ равны 1 моль/л.
Например, для реакции H2 + N2 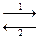 2HI имеем:
2HI имеем:
v1 = k1´[H2]´[I2], v2 = k2´[HI]2. При этом:
– если [H2] увеличивается в 2 раза, то и v1 увеличивается в 2 раза, а v2 не изменяется;
–если [HI] увеличивается в 2 раза, то v1 не изменяется, а v2 увеличивается в 4 раза;
–если давление p увеличивается в 2 раза, то все концентрации увеличиваются в 2 раза, при этом и v1 и v2 увеличиваются в 4 раза.
Скорость реакции не зависит от концентрации твердых веществ, которая остается постоянной, а зависит от площади их поверхности. Так, для реакции CaO(тв) + CO2(газ) CaCO3(тв) имеем: v1 = k1´[CO2], так как [CaO]=const, v2=k2, так как [CaCO3]=const.
Простые реакции - это реакции, которые идут согласно стехиометрическому уравнению, отражающему элементарный акт реакции.
Сложная реакция - это сумма нескольких простых реакций. Уравнение сложной реакции не отражает процесса на молекулярном уровне.
Молекулярность реакции - это число молекул, участвующих в элементарном акте реакции. Для простых реакций, например, mA + nB ® pC + qD молекулярность равна сумме коэффициентов m+n. Реакции могут быть одно-молекулярными, например, I2 ® 2I, двумолекулярными H2 + I2 ® 2HI и редко трехмолекулярными 2NO + H2 ® N2O + H2O. Реакции более высокой молекулярности не встречаются.
Порядок реакции равен сумме показателей степеней концентрации в экспериментальном выражении скорости химической реакции. Так, для сложной реакции mA + nB ® pC + qD экспериментальное выражение скорости реакции имеет вид:
v1 = k1´[А]a´[В]b и порядок реакции равен (a+b). При этом a и b находятся экспериментально и могут не совпадать с m и n соответственно, поскольку уравнение сложной реакции не отражает процессов на молекулярном уровне и представляет собой итог нескольких простых реакций. Порядок сложной реакции определяется порядком наиболее медленной его стадии. Порядок простой реакции совпадает с молекулярностью этой реакции.
Например, для реакции 2HI + H2O2 ® 2H2O + I2 экспериментальное выражение скорости записывается в виде v=k´[HI]´[H2O2]. Это обусловлено тем, что указанная реакция является сложной и идет в две стадии:
1. HI + H2O2 ® HOI + H2O медленно
2. HOI + HI ® I2 + H2O быстро.
Кинетика общей реакции определяется первой медленной стадией.
Влияние температуры. Скорость реакции зависит от числа эффективных столкновений молекул. Эффективные столкновения происходят только между активными молекулами. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую энергию активации Еакт. и увеличивает скорость химической реакции.
Правило Вант-Гоффа. При увеличении температуры на 10° скорость реакции увеличивается в 2 - 4 раза.
Математически это записывается в виде: v2 = v1´g(t2-t1)/10,
где v1 и v2 - скорости реакции при начальной (t1) и конечной (t2) температурах, g - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
Пример. Как изменится скорость реакции при нагревании на 30°, если g=2?
Решение: V = V
= V ´2
´2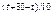 = 8V
= 8V
Ответ: Скорость увеличится в 8 раз.
Правило Вант Гоффа является приближенным. Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса: k = A´e-E/(RT), где k - константа скорости, А - постоянная, не зависящая от температуры, е = 2,71828, Е - энергия активации, R - газовая постоянная R=8,312Дж/(К´моль); Т - температура (К).
Влияние катализатора. Катализаторы увеличивают (или уменьшают) скорость реакции и остаются практически неизменными после реакции. В случае равновесия катализатор одинаково увеличивает скорость прямой и скорость обратной реакции, не сдвигая равновесия. Если вещества могут реагировать по разным механизмам, катализатор направляет реакцию по одному из них, проявляя селективное действие.
Например, при горении аммиака на воздухе имеем:
2NH3 + 3/2O2 ® N2 = 3H2O.
В то время как в присутствии металлической платины реакция идет по другому пути:
2NH3 + 5/2O2 ® 2NO = 3H2O.
Гомогенный катализ - катализатор образует с веществами одну фазу (жидкую или газообразную). Например, окисление SO2 в SO3 в присутствии NO. Без катализатора реакция
SO2 + 1/2O2 ® SO3 идет медленно. В его присутствии быстро идут процессы: NO + 1/2O2 ® NO2 и SO2 + NO2 ® SO3 + NO или суммарно SO2 + 1/2O2 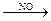 SO3.
SO3.
Гетерогенный катализ - катализатор образует отдельную фазу - твердую - в присутствии жидких или газообразных веществ. Примером может служить вышеприведенная реакция окисления аммиака в присутствии металлической платины.
Автокатализ - один из продуктов реакции играет роль катализатора. Примером автокаталитической реакции является реакция:
2KMnO4 + 5C2H2O4 + 3H2SO4 ® 10CO2 + 2MnSO4 + K2SO4 + 8H2O, где образующиеся ионы Mn2+ увеличивают скорость реакции.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!