
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды. Водородный показатель
|
|
|
|
Вода - слабый электролит - диссоциирует, образуя ионы H+ и OH-. Эти ионы гидратированы, то есть, соединены с несколькими молекулами воды, но для простоты мы записывали их в негидратированной форме
H2O H+ + OH-.
H+ + OH-.
Применяя к этому равновесию закон действия масс, имеем:
K = 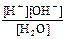 = 1,8×10-16 (22°С)
= 1,8×10-16 (22°С)
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л: 18 г/моль = 55,5 моль/л. Получаем
К´[H2O] = К(H2O) = [H+]×[OH-] = 10-14 (22°С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22°С: [H+]×[OH-] = 10-14
Ионное произведение воды увеличивается с увеличением температуры
| t°С | |||||
| K(H2O) | 0,4×10-14 | 1,0×10-14 | 1,9×10-14 | 5,6×10-14 | 74×10-14 |
Соотношение между количеством ионов [H+] и [OH-] определяет характер среды:
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+].
Аналогично рOН = - lg[OH-].
Логарифмируя ионное произведение воды, получаем
pH + pOH = 14
Примеры. Если [H+] = 10-2M, то рН = 2, а [ОH-]= 10-12M.
Если [ОH-] = 10-4M, то [H+]= 10-10M, а рН = 10.
Если рН = 8, то [H+]= 10-8M, а [ОH-] = 10-6M
Если рОН = 5, то рН = 9, а [H+]= 10-9M.
Величина рН характеризует реакцию среды:
рН = 7 нейтральная среда
рН < 7 кислая среда
рН > 7 щелочная среда.
рН раствора можно определить с помощью индикаторов (лакмуса, фенолфталеина., метилоранжа и др.), универсальной индикаторной бумаги или с помощью рН-метра.
Индикатор меняет свою окраску в зависимости от рН раствора в определенном интервале рН: метилоранж в области рН=3,1-4,4; лакмус при рН=5,0-8,0; фенолфталеин в пределах рН=8,0-10,0. Индикатор - это обычно малодиссоциированная кислота или основание, имеющие в нейтральных и ионных формах разные окраски. Так например, лакмус НА - красный, а его анион А- - синий:
НА  Н+ + А-
Н+ + А-
красный синий
В кислой среде с увеличением [Н+] равновесие сдвигается влево, индикатор имеет красный цвет. В щелочной среде, с уменьшением [Н+] равновесие сдвигается вправо, и индикатор имеет синий цвет. В области перехода в интервале рН от 5,0 до 8,0 существуют обе формы, и индикатор имеет фиолетовый цвет.
Пример 1. Найти рН 0,01 М раствора NaOH (a=1)
Решение. NaOH  Na+ + OH- a=1
Na+ + OH- a=1
[OH-] = [NaOH] = 10-2 M, рОН=2, рН=12.
Пример 2. Найти рН 0,1 М раствора NН4OH (К=1,8×10-5)
Решение. NH4OH NH4+ + OH-
NH4+ + OH-

Так как [NH4OH]» C(NH4OH), а [OH-]=[NH4+], имеем:
[OH-] = 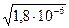 = 1,34×10-3 ; pOH = 2,87, pH = 11,13.
= 1,34×10-3 ; pOH = 2,87, pH = 11,13.
Пример 3. 0,1 М раствор СН3СООН имеет рН = 3. Найти степень диссоциации a.
Решение. СH3СОOH  СH3СОО- + H+
СH3СОО- + H+
С-Сa Сa Сa
Отсюда [H+] = Сa и a = 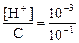 = 1×10-2, так как при рН=3 [H+]=10-3.
= 1×10-2, так как при рН=3 [H+]=10-3.
Пример 4. Раствор НСООН (К=1,8×10-4) имеет рН=1,87. Найти концентрацию кислоты С.
Решение. НСОOH НСОО- + H+
НСОО- + H+
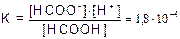 , так как [H+] = [HCOO-] имеем [HCOOH] =
, так как [H+] = [HCOO-] имеем [HCOOH] =  , так как рН=1,87, то [H+]= 1,34×10-2.
, так как рН=1,87, то [H+]= 1,34×10-2.
[HCOOH] = 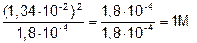 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!