
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило изотермы и адиабаты
|
|
|
|
Рабочее тело - идеальный газ.
И количеств воздействия (функций процесса q, w).
В лекции 2 представлены все способы, расчетные формулы для определения изменения функций состояния и функций процесса при любом n для любого вещества. Исключение среди них составляет процесс с n = 1, т.е. изотермический процесс. Действительно, раcчетная формула для работы деформации
w = Rу(T1 – T2) / (n – 1) и n → 1, т.е. T1 → T2,
демонстрирует неопределенность типа 0 / 0. Здесь поступаем следующим образом. Для процесса T = const и идеального газа имеем
Δu = cv|t1t2(t2 – t1) и при t2 = t1
0 = Δu = q – w → q = w = ∫pdv
и pv = RуT → p = RуT / v; подставим эту зависимость в интеграл для работы:
q = w = ∫RуT / v dv = RуT ln v2/v1 Дж/кг (3.9)
Соответственно, q = TΔs → Δs =q / T = Rу ln v2 / v1 Дж/кгК (3.10)
Таким образом, рассчитывается не абсолютное значение энтропии, а ее условное значение от s0 = 0 при избираемом удобном состоянии вещества. В инженерной практике для газов это – р = 1 бар (или 1 ата) и Т = 273К.
Замечание. Глядя на расчетные формулы (3.5) и (3.6) для истинной и средней политропной теплоемкости, видно, что при n → 1 обе теплоемкости стремятся к ±∞. Это и понятно из самого определения истинной и средней теплоемкости: делить на 0 математика не разрешает. Но это совсем не мешает рассчитать количество теплоты и изменение энтропии термодинамически, без использования калориметрии, т.е. без применения понятия теплоемкости.
Ссылка. В методических указаниях по дисциплине «Техническая термодинамика» для самостоятельной работы студентов, разработанных проф. П. Г. Алексеевым в 2003 году, МИТХТ, на стр. 16 представлена таблица 5.1, в которой приводятся в концентрированном виде все соотношения и расчетные формулы для расчета процессов при любом значении n для идеального газа.
Очень часто в инженерных задачах и в физико-химическом исследовании процессов с рабочим телом необходимо знать только знак изменения функций состояния Δu, Δh, Δs и функций процесса q, w. Сама величина этих изменений бывает и не нужна. Для решения этой задачи существует прием, позволяющий очень просто и наглядно ответить на поставленный вопрос.
Рассмотрим рис. 3.3.
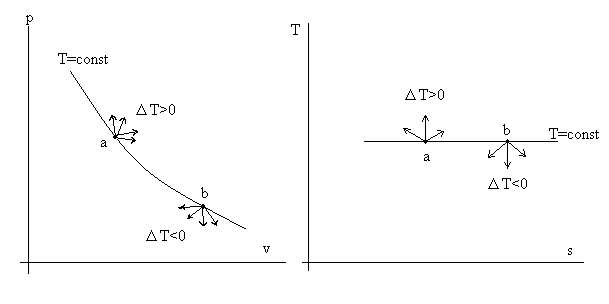
Рис 3.3. Иллюстрация правила изотермы.
На изотерме T = const возьмем произвольную точку «а». Наверное, понятно, что все процессы, выходящие из точки «а» на изотерме «вверх» (см. диаграмму T – s), характеризуются ростом температуры ΔT > 0. Зато все процессы, выходящие из точки «в» «вниз» (опять см. диаграмму T – s), дают ΔT < 0.
Рассмотрим рис.3.4.

Рис. 3.4. Иллюстрация правила адиабаты.
На адиабате s = const возьмем произвольную точку «а». Все процессы, выходящие из т. «а» вправо (см. диаграмму T – s), характеризуются ростом энтропии Δs > 0. Все процессы, выходящие из точки «в» влево (опять см. диаграмму T – s) характеризуются уменьшением энтропии Δs < 0.
Практическую работу правила изотермы и адиабаты проиллюстрируем на примере.
Пример. Определить знаки изменения энтропии Δs, функций состояния Δu, Δh и функций процесса q и w для процесса расширения идеального газа с показателем политропы n = 0,8.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!