
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кахексин (ФНО-a)
|
|
|
|
Лептин
Взаимосвязь ЖКТ и гипоталамуса
ЛИПОСТАТ
Липостат (массостат) — условное название системы, контролирующей постоянство веса тела. Липостат обеспечивается работой пищевого центра — сложного гипоталамо-лимбико-ретикуло-кортикального комплекса. Ведущим отделом пищевого центра являются латеральные ядра гипоталамуса. Липостатический гомеостаз обеспечивается путем прямых и обратных связей между:
ü гипоталамусом и кортиколимбическим структурами ЦНС
ü гипоталамусом и жировой тканью (с её гормонами)
ü гипоталамусом и ЖКТ (с его энтериновой гормональной системой).
- При приеме пищи выделяются кишечные гормоны энтериновой системы, которые ингибируют центр голода гипоталамуса:
- Сильными ингибиторами чувства голода, аппетита и пищевой активности служит холецистокинин (дуоденальный гормон), арэнтерин (12-перстная кишка)
- Менее активными ингибиторами центра голода являются бомбезин, соматостатин, сатиетин, нейротензин, кортиколиберин, тиролиберин, вазоактивный интестинальный полипептид и инсулин.
- Дериват тиролиберина — гистидилпролин дикетопиперазин — понижает аппетит, вызывает истощение. Обнаружен в крови больных психогенной анорексией.
Взаимосвязь ЦНС и гипоталамуса:
- Эндорфины и энкефалины, а также соматолиберин (вырабатываются в энтериновой системе и в ЦНС) стимулируют центр голода гипоталамуса.
- Норадреналин, известный как липолитический активатор, ингибирует центр голода гипоталамуса;
- ингибируют центр голода гипоталамуса и другие b-адреномиметики, что используется при применении амфетаминов в качестве анорексигенов. Менее активен в качестве анорексигена серотонин.
Взаимосвязь жировой ткани и гипоталамуса:
В «сытом» состоянии адипоциты вырабатывают пептидные гормоны лептин (Дж. Скотт, 1994г) и кахексин.
Лептин - пептидный гормон, состоящий из 167 аминокислот (Дж. Скотт, 1994г). Ген лептина человека локализуется на 7q31.3 хромосоме; он состоит из 3 экзонов и 2 интронов и кодируется 4,5 kb мРНК. Образование лептина стимулирует накопление ТГ в жировой ткани («сытые» адипоциты), инсулин и глюкокортикоиды. Количество лептина в крови пропорционально объему жировой ткани и физиологически выше у женщин, чем у мужчин. Секретируемый в жировой ткани лептин поступает в кровообращение в виде импульсов и наибольшее его содержание в крови наблюдается в ночное время.
Эффекты лептина:
ü В гипоталамусе нейропептид Y стимулирует пищевое поведение, поиск пиши, потребление пищи, продукцию инсулина и накопление жира в адипоцитах. Нейропептид Y ингибирует выработку ТТГ и АКТГ, понижает симпатический и повышает парасимпатический тонус, нарушает половую функцию.
ü Лептин проникает в гипоталамус, рецептируется вентромелиальнымн ядрами центре голода, подавляет выработку неpoпептида Y, стимулирует синтез ТТГ и АКТГ, повышает тонус СНС.
ü Лептин стимулирует продукцию глюкагоноподобного пептида I, подавляющего аппетит и пищевое поведение.
ü ТТГ через тиреоидные гормоны - увеличивает потребление О2 и основной обмен.
ü Лептин действует на бурую жировую ткань, стимулируя синтез белков разобщителей, что стимулирует липолиз ТГ и термогенез
ü СНС стимулирует норадренергический липолиз в жировой ткани через b-адренорецепторы.
ü АКТГ через глюкокорликоиды – стимулируют липолиз в жировой ткани.
ü активный липолиз способствует увеличению термогенеза.
В результате лептин тормозит накопление ТГ в жировой ткани.
наибольшая ритмичность пиков его повышения приходится на 22.00—3.00. У худых лиц амплитуда периодичности секреции лептина больше, чем улиц с избыточной массой тела. Количество импульсов составило 3,6 ± 0,3 в сутки; обычно они выявлялись через 2—3 ч после приема пищи.
Установлена отрицательная корреляционная связь частоты пульсовой секреции с общим количеством жира и инсулинемией. Более того, выявлена зависимость среднесуточной концентрации лептина (уровень лептина определяли каждые 20 мин у 24 женщин, находившихся в периоде пременопаузы: у 16 с ожирением и 8 с нормальной массой тела) от количества подкожной жировой клетчатки, тогда как количество висцерального (абдоминального) жира не влияло на содержание лептина в сыворотке крови. Кроме того, все характеристики секреторного профиля лептина не различались у женщин с верхним или нижним типом отложения подкожной жировой клетчатки, за исключением более высокой секреторной амплитуды у женщин с нижним типом ожирения.
Часть лептина находится в крови в связанном состоянии, соединившись с белками, причем уровень свободного лептина в кровообращении повышается с увеличением степени ожирения. У женщин содержание лептина в сыворотке крови на 40% больше, чем у мужчин. По мнению авторов, эти различия отражают резистентность к липостатическому действию лептина и могут быть обусловлены соответствующим содержанием половых гормонов (тестостерон в большей степени, чем эстрогены, снижает секрецию лептина). Половые различия в содержании лептина в сыворотке крови отмечаются не только у взрослых, но также у плодов человека и новорожденных [Jaquet D. et al., 1998]. Лептин определяется в сыворотке крови плодов человека начиная с 18-й недели беременности, а уровень его после 34-й недели значительно повышается и положительно коррелирует с индексом массы тела. У плодов женского пола уровень лептина в сыворотке крови значительно выше. Показано, что после приема пищи секреция лептина повышается, а при голодании его уровень в сыворотке крови и экспрессия гена лептина в жировой ткани снижаются.
Установлено, что секреция лептина начинается задолго до рождения ребенка. Так, Н. A. Koistinen и соавт. (1997) выявили прямую корреляционную связь уровня лептина в крови пупочного канатика со сроком беременности (уровень лептина был выше у новорожденных, родившихся при большом сроке беременности), абсолютной и относительной массой новорожденного, уровнем инсулина и массой плаценты. Кроме того, небольшая масса новорожденного при рождении и курение матери во время беременности коррелируют со снижением секреции лептина в период беременности, и эта зависимость более выражена при недоношенной беременности.
Взаимосвязь секреции лептина с функциональным состоянием щитовидной железы несомненна. Так, С. Valcavi и соавт. (1997) у больных с гипотирозом выявили снижение уровня лептина в плазме крови (4,7 ± 0,7 мкг/л при норме 8,6 ± 1,4 мкг/л), который после проведения заместительной терапии (тироксин в дозе 100—150 мкг/сут в течение 8—20 нед) повысился практически до нормальных значений — 6,3 ± 0,8 мкг/л. В то же время у больных с гипертирозом уровень лептина в плазме крови достоверно не отличался от нормы (7,2 ±1,1 мкг/л). Однако в другом исследовании установлено, что содержание лептина в сыворотке крови достоверно выше у больных гипотирозом, тогда как при тиреотоксикозе оно не отличается от уровня, отмечающегося у лиц контрольной группы, что, по мнению авторов, может быть связано с увеличением массы тела, наблюдаемым у больных с гипотирозом. Противоречивые сведения о содержании лептина в крови у больных с гипотирозом, полученные указанными авторами, пока не имеют удовлетворительного объяснения. Лептин стимулирует кроветворение in vitro и in vivo в эмбриональный период жизни плода человека. Установлена положительная корреляционная связь уровня лептина в сыворотке крови с содержанием различных цитокинов, включая a-ФНО. Кроме того, С. S. Mantzoros и соавт. (1997) выявили четкую положительную корреляционную связь между содержанием лептина в плазме крови, индексом массы тела, уровнями инсулина и a-ФНО у больных сахарным диабетом типа 2. По мнению авторов, a-ФНО играет определенную роль в регуляции секреции лептина у человека.
В соответствии с липостатической теорией следовало бы ожидать, что лептин является гормоном "антиожирения", и, следовательно, при ожирении имеется недостаточность секреции лептина. Однако лишь в одном случае при ожирении у человека удалось доказать наличие врожденной недостаточности лептина у гомозигот. Обследовано 2 ребенка (двоюродные брат и сестра), у которых при значительном ожирении (на долю жировой ткани приходилось более 50% массы тела) отмечалось низкое содержание лептина в сыворотке крови. Секвенирование кДНК у этих детей показало отсутствие одного остатка гуанидина в гене лептина, что приводило к сдвигу рамки считывания на отрезке мРНК, кодирующем карбоксильный участок аминокислотной последовательности гормона. Вследствие такого нарушения гена синтезировался биологически неактивный лептин, что и было причиной развития необычной формы ожирения.
Теоретически - чем больше лептина, тем меньше потребление пищи. В норме существует так называемая точка липостаза (по аналогии с гомеостазом). Наличие подобного контроля объясняет ситуацию, когда больной, потеряв 40 кг за короткий период, вновь резко набирает массу тела. Когда лептин был открыт, то казалось, что проблема ожирения решена и назначение лептина позволит нормализовать вес большинства тучных больных, все похудеют. Но в целом на земле более 1 млрд людей страдают ожирением, при этом обнаружено лишь несколько детей с низким уровнем лептина. Абсолютный дефицит лептина - редчайшая патология, характеризующаяся тяжелым ожирением с раннего детства.У подавляющего большинства тучных людей уровень лептина повышен. На сегодняшний день эту ситуацию понять нетрудно. Мы знаем, что у больных сахарным диабетом 2 типа уровень инсулина повышен(инсулинорезистентность), но при этом чувствительность к инсулину снижена. Аналогичная ситуация создается и по отношению к лептину – выше уже было сформулировано понятие лептинорезистентности (резистентность к лептину нередко сочетается с инсулинорезистентностью).Существует несколько гипотез относительно появления резистентности к лептину. Одна из них - у людей с резистентностью к лептину последний плохо проникает через гематоэнцефалический барьер. Поскольку лептин циркулирует в связанном с транспортным белком виде, резистентность к нему связывают с аномалиями в структуре связывающего белка. Возможной причиной является аномалия гипоталамических рецепторов. Во время голодания и при активной физической нагрузке уровень лептина снижается.
Лептин, по-видимому, относится к "генами экономии" (thrifty genes). Если рассматривать его роль в эволюционном аспекте, то, вероятно, в то время, когда наши предки питались нерегулярно и постоянно наблюдались большие промежутки между приемами пищи, необходимой для восполнения энергии в организме (удачная охота на мамонта или другого дикого зверя, успешная рыбалка), роль лептина заключалась в эффективном сохранении энергии в тот период, когда пища была недоступна и для выживания требовались большие запасы энергии. Рассматривая обмен веществ при сахарном диабете, J. Neel (1962) охарактеризовал это состояние, как обусловленное "генами экономии".Он предложил концепцию, в соответствии с которой нужен "быстрый триггер инсулина", который регулирует процесс, необходимый для сохранения энергии при достаточном количестве пищи. Такие запасы энергии в виде жировых депо обеспечивают длительное выживание организма в неблагоприятных условиях, сочетающихся с голоданием. Такой вид инсулиновой секреции, по мнению J. Neel, должен приводить к инсулиновой резистентности, которая в дальнейшем способствует развитию диабета при условии постоянного наличия достаточного количества пищи. [2;2000, 1;2001]
a-фактор некроза опухолей (a-ФНО) пептид, синтезируется в адипоцитах, мышцах. Синтез a-ФНО стимулирует накопление ТГ в адипоцитах. Концентрация a-ФНО в сыворотке крови составляет 90 ± 10 пг/мл.
a-ФНО ингибирует действие инсулина на адипоциты и миоциты, не ингибирует действие инсулина на гепатоциты.
Ожирение повышает экспрессию гена a-ФНО и вызывает инсулинорезистентность. Содержание a-ФНО значительно выше нормы (22 ± 8 пг/мл) у больных сахарным диабетом типа 2, у больных, страдающих только ожирением, (78 ± 12).
Действуя на печень и, возможно, на гипоталамус, кахексин снижает аппетит и усиливает катаболизм.
a-ФНО действует через мембранные рецепторы: TNFR1, (мол. масса 60 кДа) и TNFR2 (мол. масса 80 кДа), которые есть у всех клеток.
a-ФНО через рецептор TNFR1 опосредует все виды действия цитокина — апоптоз, дифференцировку и пролиферацию клеток.
a-ФНО через рецептор TNFR2 — опосредует метаболические эффекты цитокина:
ü ингибирует автофосфорилирование b-субъединиц инсулинового рецептора под действием инсулина, в результате рецептор инсулина не передает сигнал в клетку.
ü ингибирует фосфорилирование IRS-1 b-субъединицой инсулинового рецептора, в результате рецептор инсулина не передает сигнал в клетку
ü уменьшает экспрессию гена, ответственного за синтез ГЛЮТ-4 в жировой ткани, что сопровождается снижением поглощения глюкозы адипоцитами (эффект проявляется при дозах, значительно меньших, которые требуются для угнетения экспрессии гена ГЛЮТ-4).
ü снижает экспрессию гена липопротеинлипазы.
2. Межорганный уровень регуляции липидного обмена (Глюкозожирнокислотный цикл - цикл Рендла).
Какой процесс будет преобладать в организме — синтез липидов (липогенез) или их распад (липолиз), зависит от поступления пищи и физической активности. В абсорбтивном состоянии под действием инсулина происходит липогенез, в постабсорбтивном состоянии — липолиз, активируемый глюкагоном. Адреналин, секреция которого увеличивается при физической активности, также стимулирует липолиз.
Абсорбтивный период
Абсорбтивным называют период пищеварения. В абсорбтивный период происходит поступление с пищей глюкозы, аминокислот и ТГ. Процесс пищеварения и высокая концентрации в крови глюкозы и аминокислот активирует секрецию инсулина и снижает секрецию глюкагона в поджелудочной железе.
· Инсулин стимулирует использования метаболитов для запасания энергоносителей. Он активирует синтез гликогена в мышцах и печени, ТГ - в печени и жировой ткани, белков – в мышцах и печени.
· Инсулин подавляет глюконеогенез в печени, липолиз в жировой ткани, катаболизм белков в мышцах и печени.
Главный потребитель глюкозы - печень, она фиксирует до 60% всей поступившей глюкозы. Синтезированные в печени и жировой ткани ТГ запасаются в основном в жировой ткани. Биосинтез ЖК de novo в жировой ткани человека протекает с высокой скоростью только после предшествующего голодания.
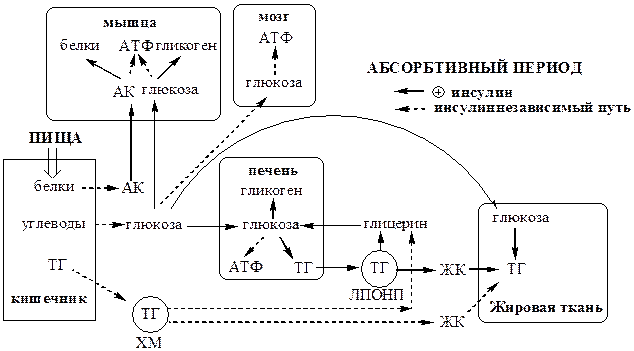 Постабсорбтивным называют период после завершения пищеварения до следующего приёма пищи. Голодание - это состояние, когда пища не принимается в течение суток и более.
Постабсорбтивным называют период после завершения пищеварения до следующего приёма пищи. Голодание - это состояние, когда пища не принимается в течение суток и более.
Постабсорбтивный период
Снижение в постабсорбтивный период концентрации в крови глюкозы подавляет секрецию инсулина и стимулирует секрецию глюкагона в поджелудочной железе.
· Глюкагон ускоряет процессы мобилизации депонированных энергоносителей. Он стимулирует липолиз в жировой ткани, гликогенолиз (гликоген расходуется за 18—24 ч), глюконеогенез (активируется через 4—6 ч после приема пищи), β-окисление ЖК в печени, катаболизм белков в мышцах и печени, запускает в печени синтез КТ из ЖК.
· Глюкагон подавляет синтез гликогена в мышцах и печени, ЖК и ТГ - в печени и жировой ткани, белков – в мышцах и печени.
Метаболизм направлен, главным образом, на поддержание концентрации в крови глюкозы, которая служит основным энергетическим субстратом для мозга и единственным для эритроцитов.
В результате в крови повышается количество ЖК (в 2 раза), которые становятся важными источниками энергии для печени, мышц, сердца, почек, и жировой ткани. Т1/2 ЖК в крови тоже очень мал (менее 5 мин), что означает существование быстрого потока ЖК из жировой ткани к другим органам.
Период голодания
Голодание может быть кратковременным, в течение суток (I фаза), продолжаться в течение недели (II фаза) или нескольких недель (III фаза).
В отсутствие пищи в крови снижается уровень глюкозы, АК и ТГ. При низкой концентрации инсулина и высокой глюкагона, повышается концентрация кортизола.
Кортизол стимулирует катаболизм белков, аминокислот в тканях и анаболизм белков, аминокислот, глюконеогенез и синтез гликогена в печени, тормозит потребление глюкозы периферическими тканями. Избыток кортизола стимулирует липолиз в конечностях и липогенез в туловище и на лице, подавляют воспалительные и иммунные реакции, ингибируют фосфолипазу А2, вызывая гибель лейкоцитов.
На фоне преобладания процессов катаболизма липидов и белков происходит снижение общего метаболизма. Основным источником глюкозы при длительном голодании служит глюконеогенез. Глюкоза используется только инсулиннезависимыми тканями, в основном мозгом, эритроцитами. Обеспечение энергетических потребностей других тканей происходит за счёт ЖК и КТ.
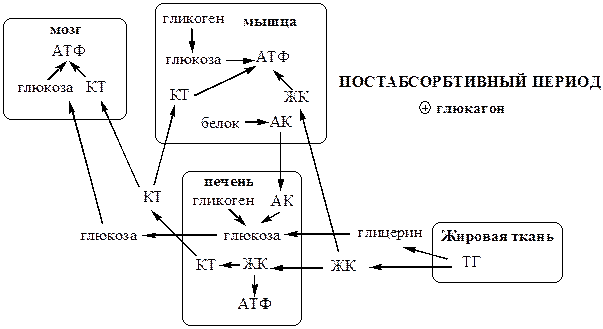
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 582; Нарушение авторских прав?; Мы поможем в написании вашей работы!