
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робочі і стандартні розчини перманганатометрії
|
|
|
|
Приготування розчину калій перманганату. Для приготування 1л 0,1 н. розчину КМпО4, зважують на технічних терезах близько 3,2г препарату, що становить 1/50 частину молекулярної ваги. Наважку переносять у мірну колбу і заливають приблизно наполовину дистильованою водою, після чого старанно перемішують до повного розчинення кристалів КМпО4.
Встановлювати СН розчину перманганату за вихідною речовиною доцільно через 10-12 днів після приготування. У перші дні концентрація розчину помітно змінюється внаслідок відновлення перманганату домішками органічних речовин (пилом), які попадають у дистильовану воду з повітря. Більш стійкі розчини можна приготувати, якщо для розчинення наважки застосувати свіжоперегнану дистильовану воду. Розчин перманганату треба захищати від світла, тому що під дією світла відбувається самовільне відновлення КМпО4. Тому приготований розчин треба зберігати в склянці з темного скла, закритій скляною пробкою.
Перед установленням молярної концентрації еквіваленту розчину КМпО4 осад манган (IV) оксиду, який може утворитись при розкладанні перманганату під впливом світла або органічних домішок, треба відділити фільтруванням крізь скляний фільтр або декантацією в приміщенні, вільному від пилу.
Вихідні речовини методу перманганатометрії. В якості вихідних речовин перманганатометрії використовують оксалатну кислоту або натрій оксалат. Оксалатна кислота окиснюється розчином калій перманганату за рівнянням: С2О42– 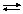 2
2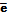 + 2СО2.
+ 2СО2.
Оксалатна кислота кристалізується з двома молекулами води, її склад відображає формула Н2С2О4∙2Н2О. Кристалізаційна вода з часом поступово вивітрюється, тому препаратом оксалатної кислоти, який зберігався тривалий час, не можна безпосередньо користуватись для встановлення концентрації перманганату. Оксалатну кислоту спочатку перекристалізовують. Для цього беруть таку наважку оксалатної кислоти, яка потрібна для приготування насиченого розчину, розчиняють її в киплячій дистильованій воді і відфільтровують гарячий розчин від нерозчинних домішок. Гарячий фільтрат швидко охолоджують холодною водою. Дрібні кристали Н2С2О4∙2Н2О відділяють фільтруванням, віджимають між аркушами фільтрувального паперу і висушують на повітрі
Для встановлення молярної концентрації еквіваленту розчину КМпО4 користуються 0,1н розчином оксалатної кислоти: 1,5600г Н2С2О4 ∙ 2Н2О відважують на аналітичних терезах, переносять наважку у мірну колбу на 250 см3, розчиняють її в дистильованій воді і доводять водою до риски, після чого розчин у колбі старанно перемішують.
Перевага при використання в якості вихідної речовини натрій оксалату у тому, що він кристалізується безводним. Тому натрій оксалат у сухому стані не зазнає ніяких змін і може зберігатись будь-який час.
Встановлення молярної концентрації еквіваленту (СН) розчину перманганату. Реакція між перманганатом калію і щавлевою кислотою відбувається за рівнянням:
2KMnO4 + 5H2C2O4 + 3H2SO4 → K2SO4 + 2MnSO4 + 10CO2 +8H2O
Відбирають піпеткою 20 або 25 cм3 0,1н. розчину оксалатної кислоти і переносять у конічну колбу місткістю 200 см3. Добавляють до нього 15-20 см3 розчину сульфатної кислоти (1:4) і нагрівають на електричній плитці або газовому пальнику до температури 80-90°С. При цьому треба стежити, щоб стінки колби вище рівня рідини надто не перегрівались: це може призвести до утворення на стінках сухої кірочки оксалатної кислоти і до її розкладання під впливом високої температури.
Замість нагрівання на плитці чи пальнику можна до розчину оксалатної кислоти долити певну кількість киплячої води з таким розрахунком, щоб температура суміші в колбі після цього дорівнювала приблизно 70-80°.
До гарячого розчину оксалатної кислоти добавляють з бюретки кілька краплин розчину перманганату і чекають, поки зникне рожеве забарвлення. Після цього добавляють наступні порції перманганату, щоразу чекаючи знебарвлення розчину. Після добавляння 2-3 см3 розчину перманганату титрування відбувається швидше і робочий розчин можна добавляти більшими порціями. Наприкінці титрування розчин забарвлюється в рожевий колір, який не зникає довгий час. Це є ознакою кінця титрування. Визначення треба повторити з новими кількостями розчину оксалатної кислоти ще два-три рази, причому розходження між окремими паралельними пробами не повинно перевищувати 0,02-0,03 см3. Відлічувати об'єм робочого розчину, витраченого на титрування, зручно за верхнім меніском рідини в бюретці. Обчислюють Сн розчину перманганату:

де Сн – молярна концентрація еквіваленту розчинів калій перманганату калію і оксалатної кислоти, моль/л; V – об'єми розчинів калій перманганату, витраченого на титрування, та оксалатної кислоти, взятого для аналізу, см3.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3674; Нарушение авторских прав?; Мы поможем в написании вашей работы!