
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенціометричні методи аналізу
|
|
|
|
Електрохімічні методи аналізу
Потенціометричний метод, заснований на вимірюванні електрорушійних сил (ЕРС) оборотних гальванічних елементів. Його використовують для визначення вмісту речовин в розчині і вимірювання різних фізико-хімічних величин.
Оборотний гальванічний елемент складається з електроліту і двох оборотних електродів. У найпростішому оборотному електроді, або напівелементі, електрод з елементарної речовини знаходиться в контакті з розчином, що містить йони речовини електроду. Прикладом оборотного гальванічного елемента є елемент Даніеля-Якобі, в якому використовуються мідний електрод, занурений в розчин СuSO4, і цинковий електрод, занурений в розчин ZпSО4; розчини розділені пористою перегородкою, проникної для йонів. В цьому елементі відбувається рух електронів від цинкового електроду до мідного, оскільки цинк більш активний метал, при цьому цинковий електрод розчиняється, а на поверхні мідного електроду виділяється мідь з розчину СuSO4. Якщо здійснити процес у зворотному напрямку, приєднавши гальванічний елемент Даніеля-Якобі до зовнішнього джерела і пропускаючи через нього електричний струм, то процес в гальванічному елементі буде перебігати зворотно – на цинковому електроді відкладається цинк і концентрація ZпSО4 в розчині електроліту зменшиться, а мідний електрод почне розчинятися і концентрація Сu2+ в розчині електроліту збільшиться.
У потенціометрії зазвичай застосовують гальванічний елемент, що включає два електроди, які можуть бути занурені в один і той же розчин (елемент без переносу) або в два різних за складом розчини, що мають між собою рідинний контакт (ланцюг з переносом). Електрод, потенціал якого залежить від активності (концентрації) визначуваних в розчині йонів, називається індикаторним. Для вимірювання потенціалу індикаторного електроду в розчин занурюють другий електрод, потенціал якого не залежить від концентрації йонів, що визначаються. Цей електрод називається електродом порівняння. В якості електроду порівняння використовують насичений каломельний і хлоридсрібний електроди (рисунок 11.1).
У потенціометричному методі аналізу використовують два основні класи електродів:
ü електронообмінні електроди, на межах розділу фаз який протікають реакції з участю електронів;
ü мембранні або йонообмінні, їх називають також йоноселективні електроди, на межі розділу фаз яких протікають йонообмінні реакції.
Йоноселективні електроди діляться на групи: скляні; тверді з гомогенною або гетерогенною мембраною; рідинні (на основі йонних асоціативів, хелатів металів або нейтральних лігандів); газові; електроди для вимірювання активності (концентрації) біологічних речовин.
Найпростіший електронообмінний електрод – металева пластинка, занурена в розчин або розплав електроліту Zn/Zn2+; Cu/Cu2+ і т.д. Мембранні електроди мають форму пластинок з йонообмінного матеріалу, що контактують з двома розчинами електроліту MX 1(c1)/мембрана/ MX 2(c2).
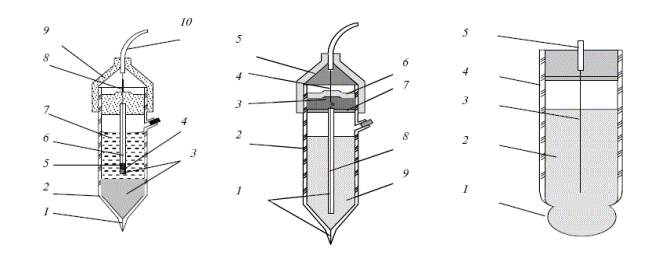
Серед індикаторних йоноселективних електродів найбільше застосування отримав скляний електрод, призначений для вимірювання pH (рисунок 11.1).
| а) | б) | в) |
| 1 – азбестова нитка; | 1 – азбестова нитка; | 1 – мембрана; |
| 2 – скляний корпус; | 2 – скляний корпус; | 2 – внутрішній розчин; |
| 3 – кристали KCl; | 3 – порожнина малого об’єму; | 3 – струмовідводний хлоридсрібний електрод; |
| 4 – каломельна паста; | 4 – срібний дріт; | 4 – корпус; |
| 5 – ртуть; | 5 – ущільнення; | 5 – провід |
| 6 – платиновий дріт; | 6-7 – гумова трубка; | |
| 7 – розчин KCl; | 8 – скляна трубка; | |
| 8 – спай; | 9 – розчин KCl | |
| 9 – ущільнення; | ||
| 10 – провід |
а – каломельний електрод; б – хлоридсрібний електрод;
в – скляний електрод
Рисунок 11.1 – Типи електродів
Скляний електрод – це умовна назва нескладної системи, що включає невелику посудину з ізолюючого скла, до нижньої частини якої припаяна кулька із спеціального електродного скла. Такий електрод забезпечений токовідводом. В якості внутрішнього стандартного розчину в скляному електроді використовують 0,1 М розчин НCl звичайно з добавкою хлориду натрію і калію. Можна використовувати також будь-якої буферний розчин з добавкою хлоридів або бромідів. Струмовідводом служить хлоридсрібний електрод, який представляє собою срібний дріт, покритий хлоридом срібла.
Скляний електрод зазвичай використовують в парі з хлоридсрібним електродом порівняння. Застосовуваний при цьому електрохімічний ланцюг можна записати наступним чином:
Ag, AgCl | HCl (0,1 M) | | скло | | досліджуваний розчин | | KCl нас.| AgCl, Ag.
Скляний Хлоридсрібий
електрод електрод
Потенціал скляного електрода обумовлений обміном йонів лужних металів, що знаходяться в склі з йонами водню з розчину. Енергетичний стан йонів в склі і розчині різний. Це призводить до того, що йони водню так розподіляються між склом і розчином, що поверхні цих фаз набувають протилежні заряди, між склом і розчином виникає різниця потенціалів, значення якої залежить від pH розчину.
У лабораторній практиці скляні електроди застосовують, як правило, для вимірювання рН. Перед початком роботи скляні електроди слід витримати деякий час в 0,1 М розчині HCl. Ні в якому разі не можна витирати скляну кульку, так як це може зруйнувати гелієву поверхню електрода. Категорично забороняється дряпати поверхню скляного електрода гострими предметами, так як товщина скляного кульки становить десяті частки міліметра і це виведе з ладу чутливий елемент.
Розрізняють два види потенціометричних вимірювань:
Ø пряма потенціометрія – визначення концентрації йіонів, зокрема [H+], за допомогою рівняння Нернста по ЕРС гальванічного елементу. Найвідоміше застосування цього виду – рН-метрія;
Ø потенціометричне титрування засноване на використанні вимірювань електродного потенціалу для знаходження точки еквівалентності в різних реакціях.
Апаратура для проведення прямої потенціометрії і потенціометричного титрування одна й та ж. У схему потенціометричних вимірювань входять індикаторний електрод, електрод порівняння і прилад для вимірювання потенціалу. В якості останнього використовують різні рН-метри. Перед вимірюванням рН проводять підстройку приладів за буферним розчинам.
Потенціометричний аналіз широко застосовують для безпосереднього визначення активності йонів, що знаходяться в розчині (пряма потенціометрія – йонометрія), а також для індикації точки еквівалентності при титруванні по зміні потенціалу індикаторного електроду в ході титрування (потенціометричне титрування). Потенціометричне титрування засновано на використані реакцій нейтралізації, окиснення-відновлення, осадження, комплексоутворення.
Результати визначення методом потенціометричного титрування більш точні, ніж при використанні прямої потенціометрії, так як в цьому випадку поблизу точки еквівалентності невеликій зміні концентрації відповідає велика зміна потенціалу індикаторного електроду. В ході титрування вимірюють і записують ЕРС електролітичної чарунки після додавання кожної порції титранту. Спочатку титрант додають невеликими порціями, при наближенні до кінцевої точки (різка зміна потенціалу при додаванні невеликої порції реагенту) порції зменшують. Для визначення кінцевої точки потенціометричного титрування можна використовувати різні способи. Найбільш простий спосіб полягає в побудові кривої титрування – графіка залежності потенціалу електроду від обсягу титранту (рисунок 11.2, а). Інший спосіб полягає в розрахунку зміни потенціалу на одиницю зміни обсягу реагенту DЕ/ΔV (диференційна крива титрування) (рисунок 11.2, б).
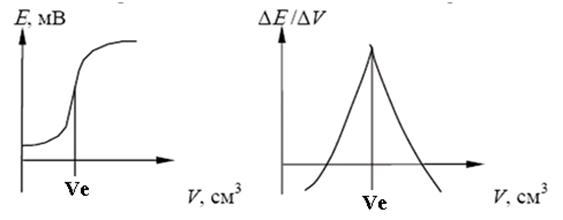 |
а) б)
а – залежність Ε від V; б – залежність ΔΕ /ΔV від V
Рисунок 11.2 – Криві потенціометричного титрування
Диференційна крива дозволяє більш точно визначити точку еквівалентності, бо в цій точці вона має гострий максимум.
Розглянуті способи засновані на припущенні, що крива титрування симетрична відносно точки еквівалентності і перегин кривої відповідає цій точці. Це припущення справедливо за умови, що речовини взаємодіють у еквімолекулярних співвідношеннях і що електродний процес повністю обернений.
При титруванні суміші електролітів на кривій титрування з’являється декілька перегинів (рисунок 11.3).
Слід зауважити, що для здійснення потенціометричного титрування суміші електролітів, необхідно щоб вони значно відрізнялись за силою (3-4 одиниці рК). Часто цього можна досягти заміною води як розчинника на диференціюючі неводні розчинники: ацетон, нітрометан, льодяна оцтова кислота та ін.
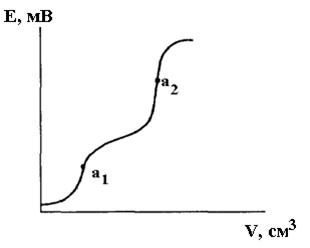 |
Рисунок 11.3 – Потенціометрична крива титрування суміші електролітів
Використання неводних розчинників спростило методики аналізу. У льодяній оцтовій кислоті добре титруються алкалоїди і вітаміни. Для титрування речовин кислотно-основного характеру краще за всіх підходить ацетон, де можна розтитрувати суміш глюконової і лимонної кислот.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7211; Нарушение авторских прав?; Мы поможем в написании вашей работы!