
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм электропроводности электролитов. Зависимость их электропроводимости от температуры. Электролиз. Законы Фарадея
|
|
|
|
Вещества, раствор которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называются электролитами. Молекулы электролита и растворителя являются дипольными. Поэтому в растворе каждую молекулу окружает группа молекул растворителя (см. рис. слева). Очевидно, что молекулы растворителя стремятся как бы разорвать молекулу электролита на две части; этому способствует также тепловое движение – колебание молекул в атоме электролита. В результате большинство молекул электролита распадается на положительные ионы (катионы) и отрицательные ионы (анионы).
Описанный процесс называется электролитической диссоциацией. Обратному процессу – воссоединению (рекомбинации) ионов электролита в нейтральные молекулы – препятствует образующаяся на иона сольватная оболочка, состоящая из молекул растворителя (см. рис. справа). Степенью или коэффициентом диссоциации называется отношение числа диссоциированных молекул электролита к общему числу его молекул:
 .
.
Степень диссоциации зависит от природы электролита и растворителя, концентрации электролита 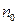 и температуры. В слабых растворах (
и температуры. В слабых растворах ( ) почти все молекулы электролита диссоциированы (
) почти все молекулы электролита диссоциированы (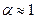 ), с повышением концентрации степень диссоциации уменьшается.
), с повышением концентрации степень диссоциации уменьшается.
При отсутствии электрического поля ионы электролита вместе со своими сольватными оболочками движутся хаотически. При наличии поля их движение упорядочивается: катионы движутся по полю, анионы – против поля. В жидкости возникает электрический ток, обусловленный встречным движением разноимённых ионов. Такого рода проводимость называется ионной.
Кроме указанных растворов ионной проводимостью обладают расплавы солей и окислов металлов: они также относятся к группе электролитов.
Определим плотность тока  в жидкости, т. е. заряд, переносимый за 1 с через воображаемую площадку в
в жидкости, т. е. заряд, переносимый за 1 с через воображаемую площадку в 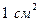 , перпендикулярную направлению движению ионов (рис. ниже).
, перпендикулярную направлению движению ионов (рис. ниже).
Так как перенос заряда осуществляется ионами обоих знаков, то
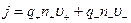 ,
,
где  и
и 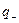 - заряды обоих катионов и анионов,
- заряды обоих катионов и анионов, 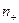 и
и  - концентрации этих ионов,
- концентрации этих ионов, 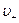 и
и  - средние скорости упорядоченного движения этих ионов.
- средние скорости упорядоченного движения этих ионов.
Учитывая, что раствор в целом нейтрален, можем написать:
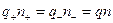 , (1)
, (1)
где  - заряд иона любого знака,
- заряд иона любого знака, 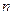 - концентрация ионов этого же знака. Заряд иона обусловлен потерей (для катиона) или сохранением (для аниона) валентных электронов при диссоциации молекулы. Поэтому, обозначив валентность электрона через
- концентрация ионов этого же знака. Заряд иона обусловлен потерей (для катиона) или сохранением (для аниона) валентных электронов при диссоциации молекулы. Поэтому, обозначив валентность электрона через  найдём
найдём
 , (2)
, (2)
где  - абсолютное значение заряда электрона. Тогда, учитывая формулы (1) и (2), получим
- абсолютное значение заряда электрона. Тогда, учитывая формулы (1) и (2), получим
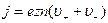 .
.
В электрическом поле на движение иона оказывают влияние две силы: во-первых ускоряющая электрическая сила
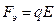 ,
,
где 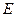 - напряжённость поля; во-вторых, тормозящая сила
- напряжённость поля; во-вторых, тормозящая сила
 ,
,
где 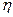 - вязкость жидкости. При установившемся движении жидкости (которое наступает практически одновременно с появлением поля)
- вязкость жидкости. При установившемся движении жидкости (которое наступает практически одновременно с появлением поля)  , тогда
, тогда
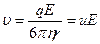 , (3)
, (3)
где 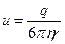 - подвижность иона. Из формулы (3) следует, что
- подвижность иона. Из формулы (3) следует, что 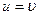 при
при 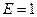 . Таким образом подвижность иона равна скорости равномерного движения этого иона под действием электрического поля единичной напряжённости.
. Таким образом подвижность иона равна скорости равномерного движения этого иона под действием электрического поля единичной напряжённости.
Учитывая формулу (3), запишем выражения для плотности тока в виде
 , (4)
, (4)
или
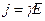 , (5)
, (5)
где
 (6)
(6)
- удельная электропроводность жидкости. Таким образом, выражения (4) и (5) представляют собой закон Ома в дифференциальной форме для жидкости. Величина
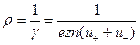 (7)
(7)
является удельным сопротивлением жидкости. Так как с повышением температуры подвижность 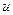 и концентрация
и концентрация 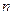 возрастают, то, согласно формуле (7), с повышением температуры сопротивление жидкости уменьшается.
возрастают, то, согласно формуле (7), с повышением температуры сопротивление жидкости уменьшается.
Подходя к электродам, ионы электролита нейтрализуются и оседают на электродах или же выделяются около электродов в виде газа (первичная реакция). Зачастую нейтрализовавшиеся ионы вновь вступают в реакцию с растворителем, образуя новые ионы, которые затем оседают на электродах (вторичная реакция).
Выделение на электродах продуктов разложения раствора электролита при прохождении через этот раствор тока называется электролизом.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!