
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Фарадея
|
|
|
|
Количественные закономерности электролита установил английский физик М. Фарадей. Эти закономерности нетрудно вывести теоретически на основе представления об ионной проводимости.
Если за время 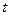 у электрода нейтрализуется
у электрода нейтрализуется 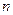 ионов, каждый из которых имеет валентность
ионов, каждый из которых имеет валентность  и массу
и массу 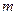 , то электрод получит заряд
, то электрод получит заряд
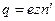 ,
,
где  - заряд электрона. При этом на электроде осядет масса вещества
- заряд электрона. При этом на электроде осядет масса вещества  .
.
Отношение
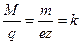 (8)
(8)
есть постоянная для данного вещества величина, называемая электрохимическим эквивалентом этого вещества. Очевидно, что электрохимический эквивалент равен количеству вещества, выделяющегося на электроде при прохождении через раствор единицы количества электричества. Из формулы (8) следует, что
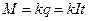 ,
,
где 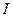 - сила тока, протекающего через раствор.
- сила тока, протекающего через раствор.
Первый закон Фарадея. Масса вещества, выделяющегося на электроде пропорциональна количеству электричества, прошедшего через раствор.
Умножим и разделим (8) на постоянную Авогадро 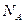 :
:
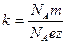 .
.
Учитывая, что 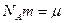 - молярная масса вещества, получим
- молярная масса вещества, получим
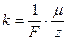 ,
,
где
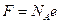
- универсальная постоянная, называемая постоянной Фарадея. Отношение 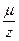 называется химическим эквивалентом вещества.
называется химическим эквивалентом вещества.
Второй закон Фарадея. Электрохимический эквивалент вещества пропорционален его химическому эквиваленту.
Объединив оба закона Фарадея, получим
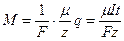 ,
,
откуда следует, что 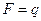 при
при  , т. е. постоянная Фарадея равна количеству электричества, при прохождении которого через раствор на каждом из электродов выделяется количество вещества, равное химическому эквиваленту.
, т. е. постоянная Фарадея равна количеству электричества, при прохождении которого через раствор на каждом из электродов выделяется количество вещества, равное химическому эквиваленту.
Согласно опытным данным,
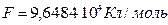
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 269; Нарушение авторских прав?; Мы поможем в написании вашей работы!