
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия, закон Гесса
|
|
|
|
Раздел химии, в котором изучают тепловые эффекты химических реакций, называется термохимией. Термохимия оперирует так называемыми термохимическими уравнениями, представляющими собой обычные химические уравнения, в которых указана величина сопровождающего реакцию теплового эффекта и термодинамическое состояние каждого из участников. Под последним понимают температуру, агрегатное состояние участников, состав и концентрации растворов.
Термодинамика использует так называемую эгоистическую систему знаков величин тепловых эффектов: экзотермическим процессам, идущим с тепловыделением, соответствуют отрицательные величины энтальпий. Наоборот, эндотермическим процессам соответствуют положительные значения величин DH и DU. Примеры термохимических уравнений процессов:
N2 (г) + 3H2 (г)= 2NH3 (г); DH298 = – 92 кДж;
NaOH (р-р NaOH × 100 H2O) + HCl (р-р HCl × 100 H2O) =
= NaCl (р-р NaCl × 201 H2O) + H2O (ж); DH298 = – 57 кДж
Нижний подстрочный индекс у величин DH указывает температуру, к которой отнесен тепловой эффект.
Рассмотрим систему, в которой отсутствует полезная работа. Тогда, согласно (1.1) и (1.4) при постоянном объеме: QV=DU, а при постоянном давлении согласно (1.8): QP=DH. Иными словами, в этих двух случаях тепловой эффект процесса не зависит от пути перехода от исходных веществ к продуктам реакции. Эта закономерность и представляет собой основной закон термохимии, установленный чисто экспериментально в 1840 г. нашим соотечественником Г.И. Гессом: энтальпия (внутренняя энергия) химической реакции не зависит от пути перехода от начальных веществ к продуктам реакции, а определяется только видом и состоянием этих исходных веществ и продуктов. Закон Гесса позволяет производить с термохимическими уравнениями алгебраические операции: складывать, вычитать, умножать и делить на постоянное число. Проиллюстрируем это на простом примере. Пусть известны энтальпии следующих процессов:
1)  N2 (г) +
N2 (г) +  O2 (г) = NO (г); DH1 = 90,2 кДж;
O2 (г) = NO (г); DH1 = 90,2 кДж;
2) NO (г) +  O2 (г) = NO2 (г); DH2 = – 56,8 кДж;
O2 (г) = NO2 (г); DH2 = – 56,8 кДж;
Необходимо найти энтальпию процесса:
3)  N2 (г) + O2 (г) = NO2 (г); DH3 .
N2 (г) + O2 (г) = NO2 (г); DH3 .
Как видно, искомое термохимическое уравнение получается сложением первого и второго термохимических уравнений, соответственно:
DH3=DH1+DH2=90,2+(–56,8)=33,4 кДж.
Различным типам физических и химических процессов соответствуют различные величины энтальпий:
К(к) = К(ж); DHплавл
H2O (ж) = H2O (г); DHиспар
NaOH (р-р) + HBr (р-р) = NaBr (р-р) + H2O (ж); DHнейтр .
Наиболее важны энтальпии образования и энтальпии сгорания. Под энтальпией образования вещества понимают энтальпию процесса образования 1 моль этого вещества из простых веществ при данной температуре. При этом совершенно безразлично – осуществим этот процесс или нет. Примеры (Т=298,15 К):
Ca (к) + C (к,графит) + 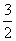 O2 (г) = CaCO3 (к); DH=DHобр CaCO3 (к);
O2 (г) = CaCO3 (к); DH=DHобр CaCO3 (к);
N2(г)+2Cr(к)+4H2(г)+ O2(г) = (NH4)2Cr2O7 (к); DH=DHобр(NH4)2Cr2O7(к).
O2(г) = (NH4)2Cr2O7 (к); DH=DHобр(NH4)2Cr2O7(к).
Отметим, что при наличии у простого вещества аллотропных модификаций в термохимических уравнениях для энтальпий образования используется наиболее устойчивая из них. При 298,15 К из аллотропных модификаций углерода таковой является графит, у олова – олово белое, у серы – сера ромбическая т. д. Единственное исключение – фосфор, для которого в качестве простого вещества взят не более устойчивый красный фосфор, а более реакционноспособный белый фосфор.
Под энтальпией сгорания вещества понимают энтальпию сгорания 1 моль этого вещества при данной температуре с образованием CO2(г)
и H2O(ж), состав остальных веществ указывают специально, например:
(CH3)2S(г)+ O2(г) = 2CO2(г)+3H2O(ж)+S(к); DH=DHсгор(СH3)2S до S
O2(г) = 2CO2(г)+3H2O(ж)+S(к); DH=DHсгор(СH3)2S до S
(CH3)2S(г)+ O2(г) = 2CO2(г)+3H2O(ж)+SO2 (г);
O2(г) = 2CO2(г)+3H2O(ж)+SO2 (г);
DH=DHсгор(СH3)2S до SO2 .
Особое значение имеют стандартные величины; они относятся к процессам, где все участники находятся в так называемых стандартных состояниях.
За стандартное состояние индивидуальных жидких и кристаллических веществ принимается их реальное состояние при данной температуре и давлении 1 атм (101325 Па).
Определения стандартных состояний для газов и растворов связаны с понятиями "идеальный газ" и "идеальный раствор". Как известно, состояние всех идеальных газов (и части реальных газов при низких давлениях) описывается уравнением Менделеева-Клапейрона:
PV=nRТ, (1.9)
где n - число молей газа.
Уравнения же состояния реальных газов сложны, громоздки и практически индивидуальны для каждого газа. С целью сохранить простую и единообразную форму описания всех реальных газовых систем поступают следующим образом. Вводится функция, называемая фугитивностью f или летучестью, рассматриваемая как исправленное давление, и все проблемы отклонений свойств реальных газов от свойств идеальных газов сводятся к нахождению этой величины. Другими словами фугитивностью называют такую величину, которая связана с другими термодинамическими характеристиками реального газа так же, как с ними связано давление в случае идеального газа. Таким образом, уравнения состояния:
для идеального газа PV=nRT;
для реального газа fV=nRT
Совершенно аналогичная ситуация с идеальными и реальными растворами. Напомним, что модели идеального газа и идеального раствора идентичны, что отражается термином "идеальный раствор газов".
Активностью называют такую величину, которая связана с другими термодинамическими характеристиками реальных растворов так же, как
с ними связана концентрация в случае идеальных растворов. Активность а связана с концентрацией с через коэффициент активности g. Именно последний и отражает степень отклонения свойств реального раствора от свойств идеального раствора, его численное значение зависит от способа выражения концентрации. Обратимся теперь к определениям стандартных состояний для газов и растворов.
За стандартное состояние газообразных веществ принимают гипотетический идеальный газ, фугитивность которого равна единице, а энтальпия – энтальпии реального газа при давлении, стремящемся к нулю. За стандартное состояние раствора (в отношении растворенного вещества) принимают гипотетический идеальный раствор, активность растворенного вещества в котором равна единице, а энтальпия – энтальпии растворенного вещества в реальном бесконечно разбавленном растворе. Если же раствор рассматривается как единая система, то используется данное выше определение стандартного состояния для индивидуальной жидкости. Отметим, что в отношении только энтальпийных характеристик определения стандартных состояний газов и растворов сравнительно просты – за стандартное состояние принимается реальный бесконечно разреженный газ или реальный бесконечно разбавленный раствор, соответственно. Величины стандартных энтальпий образования обычно при 298,15К табулированы (некоторые величины приведены в табл. 1 приложения) и в первую очередь используются при расчетах стандартных энтальпий процессов. Основанием для этого является первое следствие из закона Гесса:
DHреакции = 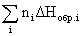 (продуктов) –
(продуктов) –  (исходных веществ), (1.11)
(исходных веществ), (1.11)
где ni и nj – числа молей (коэффициенты в уравнении).
Для этой же цели можно воспользоваться и вторым следствием из закона Гесса:
DHреакции = 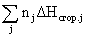 (исходных веществ) –
(исходных веществ) –  (продуктов). (1.12)
(продуктов). (1.12)
Проиллюстрируем эти закономерности на примере реакции:
3C2H2 (г) = C6H6 (ж); 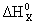 .
.
Реакции образования:
| 1) 6С (к,графит) + 3H2 (г) = С6H6 (ж) | |
| 2) 2С (к,графит) + H2 (г) = С2H2 (г) | (-3) |
Искомая реакция получается сложением первой реакции со второй, умноженной на (-3), соответственно:
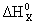 =
=  – 3
– 3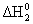 =
=  С6H6 (ж) – 3
С6H6 (ж) – 3 С2H2 (г).
С2H2 (г).
Реакции сгорания:
| 1) C6H6 (ж) + 7,5О2 (г) = 6СО2 (ж) + 3H2O (ж) | (-1) |
| 2) С2H2 (г) + 2,5 О2 (г) = 2СО2 (ж) + H2O (ж) |
Искомая реакция получается вычитанием первой реакции из утроенной второй реакции, соответственно:
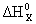 = 3
= 3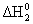 –
–  = 3
= 3 С2H2 (г) –
С2H2 (г) –  С6H6 (ж).
С6H6 (ж).
Наконец, назовем третье следствие из закона Гесса:
DH прямого процесса = - DH обратного процесса
Рассмотрим некоторые примеры использования закона Гесса.
а) Энтальпия образования кристаллогидрата из безводной соли и воды.
Пусть требуется определить энтальпию следующего процесса:
А(к) + n H2O (ж) = A×n H2O (к);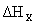 .
.
Экспериментально осуществить этот процесс и измерить его тепловой эффект практически невозможно. При этом сравнительно легко измерить энтальпии следующих процессов:
1) А(к) + Х H2O (ж) = A×((р-р, А×Х H2O); ;
;
2) А×nH2O (к) + (X-n) H2O (ж) = A ((р-р, А×Х H2O); .
.
Как видно, искомое уравнение получается вычитанием второго уравнения из первого, соответственно: DHX = DH1 - DH2 .
Можно представить рассматриваемые процессы в виде следующей схемы:

По закону Гесса энтальпия перехода из начального состояния к конечному не зависит от пути перехода, то есть DH1=DHX+DH2 .
б) Энтальпия связи.
Под энтальпией (энергией) связи А–В в молекуле АВ понимают энтальпию (энергию) разрыва 1 моль названных связей, при этом атомы разводятся на бесконечно большое расстояние. Понятно, что разорвать связи на атомы возможно только в газовой фазе. Например:
HCl (г) = H (г) + Cl (г); DH0=DH0связи H-Cl.
Под средней энтальпией связи А–В в молекуле АВn, понимают 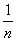 часть энтальпии разрыва всех связей в 1 моль молекул АВn до состояния атомов, атомы разводятся на бесконечно большое расстояние. Например:
часть энтальпии разрыва всех связей в 1 моль молекул АВn до состояния атомов, атомы разводятся на бесконечно большое расстояние. Например:
NH3 (г) = N (г) + 3H (г); DH0=3DH0ср.связи N-H.
Энтальпии связей могут быть найдены на основе первого следствия из закона Гесса по величинам энтальпий образования атомов и молекул; возможно и комбинирование термохимических уравнений. Например, требуется определить энтальпию связи в молекуле NO на основе данных по энтальпиям связей в молекулах N2 и О2, а также энтальпии образования NO. Запишем все исходные данные соответствующими термохимическими уравнениями:
1) N2 (г) = 2N (г); 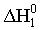 =
=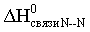 =
= ;
;
2) O2 (г) = 2O (г); 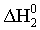 =
= =
= ;
;
3)  O2 (г) +
O2 (г) + N2 (г) = NO (г);
N2 (г) = NO (г); 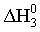 =
=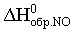 (г).
(г).
Термохимическое уравнение искомого процесса:
NO (г)=N (г)+O (г);
может быть получено вычитанием третьего уравнения из полусуммы первого и второго уравнений. Соответственно:
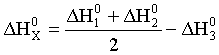 .
.
Отметим, что комбинирование термохимических уравнений собственно и привело к расчету, основанному на первом следствии из закона Гесса.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1784; Нарушение авторских прав?; Мы поможем в написании вашей работы!