
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Один из важнейших вопросов для химика, на который термодинамика дает ответ, – возможность и условия протекания химических реакций
|
|
|
|
Один из важнейших вопросов для химика, на который термодинамика дает ответ, – возможность и условия протекания химических реакций.
Самопроизвольными называют процессы, протекающие самопроизвольно, то есть без привлечения работы извне. А вот в результате осуществления таких процессов как раз и может быть выполнена работа против внешних сил. Примеры самопроизвольных процессов: переход теплоты от горячего тела к холодному, реакция нейтрализации, взрыв смеси водорода с кислородом.
Несамопроизвольными называют процессы, для протекания которых необходима затрата работы извне. Примеры несамопроизвольных процессов: переход теплоты от холодного тела к горячему, распад воды на водород и кислород при комнатной температуре.
Термодинамика оперирует так называемыми равновесными процессами, проходящими через одни и те же состояния, бесконечно близкие к равновесию. Такие процессы являются идеальными, гипотетическими. Реальные, то есть самопроизвольные процессы, в той или иной степени неравновесны.
Под химически обратимыми понимают реакции, которые могут идти в прямом и обратном направлениях. Термодинамически обратимыми называют равновесные процессы, протекающие в прямом, а затем – обратном направлениях так, что не только система, но и окружающая среда возвращаются в исходное состояние. Это без сомнения идеальные (абстрактные) процессы.
Познакомимся еще с одной термодинамической функцией – энтропией S. Ее изменение для обратимого изотермического перехода теплоты от системы к системе составляет:
DS=S2–S1=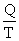 или DS=
или DS= . (1.13)
. (1.13)
Это соотношение фактически выражает второй закон термодинамики.
Для неравновесных (реальных, самопроизвольных) переходов изменение энтропии равно:
DS=(S2–S1)>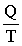 . (1.14)
. (1.14)
Объединяя эти соотношения, получим:
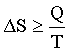 . (1.15)
. (1.15)
В этом выражении знак равенства относится к обратимым (гипотетическим, нереальным) процессам, а знак неравенства – к реальным (самопроизвольным) процессам.
Энтропия, аналогично энтальпии и внутренней энергии, является однозначной, конечной и непрерывной функцией состояния. Она зависит от природы вещества, агрегатного состояния, температуры, давления. Эта термодинамическая функция чрезвычайно чувствительна к внутреннему устройству системы, степени ее упорядоченности. Наблюдаемое (макроскопическое) состояние системы может существовать при различных распределениях молекул (частиц) по скоростям и координатам, то есть реализуется различными микросостояниями. Число таких микросостояний, которыми реализуется данное макросостояние, называется термодинамической вероятностью W. В отличие от математической вероятности, принимающей значения от нуля до единицы, термодинамическая вероятность – огромное число. Энтропия 1 моль вещества связана с термодинамической вероятностью следующим соотношением:
S=RlnW. (1.16)
По мере понижения температуры число распределений частиц системы по координатам и скоростям уменьшается, то есть уменьшается W. В пределе при 0 К частицы (молекулы) "застынут" и данное макросостояние будет реализовано одним единственным распределением частиц по координатам и скоростям, иными словами термодинамическая вероятность будет равна единице, следовательно согласно соотношению (1.16) энтропия будет равна нулю:
T ® 0 K; W ® 1; S ® 0. (1.17)
Соотношение (1.17) выражает суть третьего закона термодинамики, согласно которому при 0 К энтропия правильно образованного кристалла любого простого вещества или соединения в чистом состоянии равна нулю. Этот закон открывает путь для определения абсолютных величин энтропии. Если вещество находится в стандартном состоянии, то оно характеризуется стандартной энтропией. Величины стандартных энтропии некоторых веществ и ионов при 298,15 К приведены в табл. 1 приложения.
Отметим, что энтропия газа гораздо больше энтропии жидкости, которая в свою очередь больше энтропии кристалла (рис. 2). Это позволяет проводить оценку знака величины DS процесса, которая рассчитывается согласно соотношению:
DSреакции = 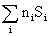 (продуктов) -
(продуктов) - 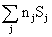 (исходных веществ).
(исходных веществ).
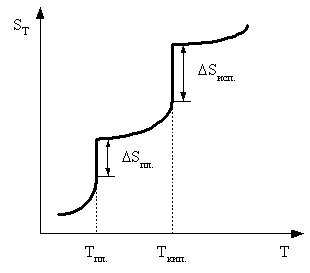
Рис. 2. Температурная зависимость энтропии
Какую же общую полезную информацию дает энтропия для химика?
1. Энтропия характеризует степень упорядоченности в системе, в данном конкретном веществе. Чем ниже S, тем меньше W, тем более компактно вещество, имеет большую твердость, плотность; кристаллические вещества характеризуются меньшей энтропией, чем аморфные вещества, энтропия возрастает с увеличением атомной и молярной масс.
2. Соотношение (1.15) для изолированной системы (Q=0) принимает вид:
DS 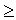 0. (1.18)
0. (1.18)
Соотношение (1.18) означает, что для изолированной системы, в которой протекают обратимые процессы, энтропия постоянна (DS=0) и возрастает (DS>0) в необратимом (реальном, самопроизвольном) процессе. Таким образом, получаем критерий самопроизвольного протекания процессов
в изолированной системе – самопроизвольно идут процессы, приводящие к росту энтропии. Очевидно, самопроизвольное течение процесса будет возможно до тех пор, пока энтропия не достигнет максимального значения. Указанный критерий весьма ограниченный, так как изолированные системы крайне редки. Познакомимся с более общим критерием, и предварительно введем еще одну термодинамическую функцию.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!