
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Истинное и кажущееся равновесие, смещение равновесия
|
|
|
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Равновесным называют такое состояние системы, которое не изменяется во времени, и эта неизменность не обусловлена протеканием какого-либо внешнего процесса. Равновесие остается неизменным, пока не меняются внешние условия. Различают истинное (устойчивое) и кажущееся (кинетическое) равновесие.
Истинное равновесие сохраняется неизменным не вследствие отсутствия процессов, а в силу протекания их одновременно в двух противоположных направлениях с одинаковой скоростью. Истинное равновесие имеет следующие признаки:
1. Если нет внешнего воздействия, то система неизменна во времени.
2. Система следует за любыми изменениями внешних условий, сколь угодно малыми они бы ни были, а если воздействие снято, то система возвращается в исходное состояние равновесия.
3. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию.
Кажущееся равновесие также неизменно во времени при отсутствии внешнего воздействия, однако второй и третий признаки для него не характерны. Примером системы в кажущемся равновесии является пересыщенный раствор: достаточно попадания соринки в такой раствор или встряхивания – и начинается выделение из раствора избыточного растворенного вещества. Другой пример – смесь водорода и кислорода при комнатной температуре: внесение в нее зажженной спички или катализатора неизбежно ведет к взрыву.
При изменении внешних условий равновесие изменяется сообразно новым условиям или, как говорят, смещается. Смещение равновесия подчиняется закономерности, называемой принципом Ле Шателье.
Он гласит: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя одно из условий, определяющих состояние равновесия, то в системе усилится течение того процесса, который будет ослаблять оказываемое воздействие, а равновесие сместится в соответствующую сторону.
Повышение температуры равновесной системы усиливает течение эндотермического процесса, охлаждение – наоборот. Например, в системе
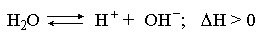
с ростом температуры равновесие диссоциации воды смещается вправо, то есть с повышением температуры усиливается диссоциация воды.
Изменение давления существенно сказывается лишь на равновесиях газовых систем. Увеличение давления для них ведет к смещению равновесия в сторону меньшего объема, падение давления – в сторону большего объема. Например, равновесие в системе

при увеличении давления смещается вправо, а при уменьшении – влево.
Увеличение концентрации исходных веществ ведет к смещению равновесия вправо (в сторону продуктов). Степень смещения равновесия при данном количестве вещества определяется величиной стехиометрического коэффициента.
Наконец, отметим, что введение в газовую систему, находящуюся при равновесии и имеющую постоянное давление, газа, не реагирующего ни с одним из компонентов, приводит к синхронному разбавлению всех участников. Следовательно, вопрос о смещении равновесия сводится к вопросу о влиянии уменьшения концентраций всех компонентов равновесной системы на положение равновесия. Согласно принципу Ле Шателье в этом случае смещение равновесия будет происходить в сторону большего объема (большего числа молей). Например, введение азота или аргона в равновесную систему
 приведет к смещению равновесия влево.
приведет к смещению равновесия влево.
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3199; Нарушение авторских прав?; Мы поможем в написании вашей работы!