
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественные характеристики равновесия
|
|
|
|
Методами термодинамики можно показать, что зависимость энергии Гиббса k -го компонента идеального газа от его парциального давления (Рk) выражается соотношением (речь идет об абсолютном значении энергии Гиббса!):
 . (2.1)
. (2.1)
Для реального газа это соотношение принимает вид:
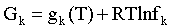 . (2.2)
. (2.2)
Аналогично выражения для энергии Гиббса m -го компонента идеального и реального растворов имеют вид (речь идет об абсолютном значении энергии Гиббса!):
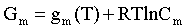 ,
,
 . (2.3)
. (2.3)
Обратим внимание, что значения функций gk(T) и gm(T) неизвестны и поэтому неизвестны абсолютные величины энергий Гиббса. Кроме того, в силу логарифмической зависимости энергии Гиббса от давления (концентрации) нельзя принимать за стандартное состояние газообразных веществ и растворов (в отношении растворенных веществ) бесконечно разреженный газ и бесконечно разбавленный раствор соответственно.
Изменение энергии Гиббса в химической реакции может быть найдено и через абсолютные величины энергий Гиббса компонентов, если бы они были известны:
 (продуктов) –
(продуктов) –  (исходных веществ), (2.4)
(исходных веществ), (2.4)
где ni и nj – числа молей (коэффициенты в уравнении). Рассмотрим равновесную газовую систему, подставим выражение (2.1) в соотношение (2.4):

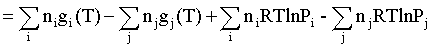
Первые слагаемые этой суммы являются функцией только температуры и в дальнейшем обозначим их через Ф(Т). С остальными слагаемыми выполним несложные математические преобразования, в результате получаем:
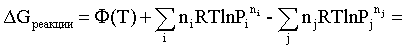
= Ф(Т) + 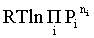 -
-  =
=
 . (2.5)
. (2.5)
При равновесии DGреакции = 0, с учетом этого для выражения (2.5) получаем:
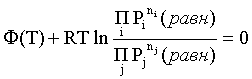 . (2.6)
. (2.6)
Логарифм отношения произведений является функцией только температуры:

 , (2.7)
, (2.7)
и пусть он равен ln KP. Выражение
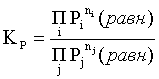 , (2.8)
, (2.8)
являющееся константой при данной температуре, называется константой равновесия. Для равновесной смеси реальных газов константа равновесия будет иметь такой же вид, но вместо давлений в ней будут фигурировать фугитивности. Повторяя эти выкладки с выражением для энергии Гиббса компонента раствора (2.3), получаем аналогичное выражение:
 . (2.9)
. (2.9)
В случае реальных растворов концентрации должны быть заменены на активности.
Для газовых равновесий величины Кр и Кс связаны:

 (2.10)
(2.10)
Например, для равновесной системы
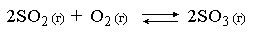
 .
.
Уравнение (2.5) является общим выражением для энергии Гиббса химической реакции. Подставляя в него соотношения (2.7 – 2.9) получаем:
 (газы);
(газы);
(2.11)
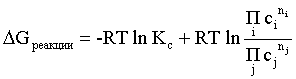 (растворы).
(растворы).
При Pi, Pj, ci и cj, равных единице (стандартное состояние!) эти соотношения переходят в одно из наиболее употребляемых уравнений термодинамики:
 . (2.12)
. (2.12)
Подчеркнем, что в уравнении (2.11) фигурирует термодинамическая константа, она равна Кр или Кс лишь в случае идеального газа или идеального раствора соответственно. Для реальных систем в выражении термодинамической константы равновесия должны быть подставлены величины фугитивностей компонентов газовой смеси или активностей компонентов раствора.
Под знаком логарифма в (2.11) стоят отношения двух величин, выраженных в одних и тех же единицах, – отношение давления к давлению в стандартном состоянии или отношение концентрации к концентрации в стандартном состоянии, то есть безразмерные величины. Таким образом, термодинамическая константа равновесия, стоящая под знаком логарифма в выражении (2.11), является безразмерной величиной. Наконец, отметим, что концентрация индивидуальных жидких и кристаллических веществ постоянна и равна единице и не включается в выражение константы равновесия.
Уравнение (2.12) является одной из основ экспериментального определения стандартных величин энергий Гиббса процессов, в частности – энергий Гиббса образования соединений. Среди других поставщиков термодинамических данных отметим электрохимические измерения. Наконец, подчеркнем, что основным поставщиком термодинамических данных являются калориметрические измерения, позволяющие определять энтальпии и внутренние энергии различных процессов, теплоемкости веществ и систем, что дает возможность определять энтальпии образования соединений и энтропии индивидуальных веществ.
Вернемся теперь к концентрационной и температурной зависимости электродного потенциала. Объединим уравнения (1.20), (1.28) и (2.10) для реального раствора:
 . (2.13)
. (2.13)
Отсюда ЭДС электрохимической системы равна:
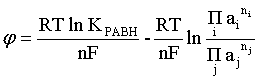 (2.14)
(2.14)
При активностях компонентов, равных единице (стандартное состояние!), это уравнение переходит в
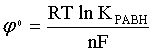 . (2.15)
. (2.15)
Сочетая (2.14) и (2.15), получаем
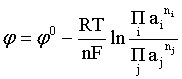 . (2.16)
. (2.16)
С учетом сказанного в разделе 1.6, соответствующее выражение для электродного потенциала имеет вид:
 . (2.17)
. (2.17)
Например, для электродных процессов:
Ni2+ + 2 ē = Ni; E1
Fe3+ + ē = Fe2+; E2
MnO4– + 8H+ + 5 ē = Mn2+ + 4 H2O; E3
выражения для электродных потенциалов будут следующими:

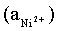 ;
;
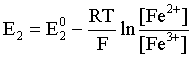
 ;
;

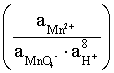 .
.
Обратим внимание, что, меняя концентрации потенциалопределяющих ионов, можно значительно изменять величину, а порой и знак электродного потенциала. Конкретные примеры, иллюстрирующие это, приведены в разделе "Задачи и упражнения" (с. 28).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!