
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шкала термодинамических функций образования ионов в водных растворах
|
|
|
|
Пример 1. На основе справочных данных определить вторую константу диссоциации ортофосфорной кислоты при 298,15 К.
Решение. Второй ступени диссоциации ортофосфорной кислоты соответствует процесс:
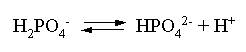
Находим стандартную энергию Гиббса этого процесса:
DG0=DG0обр H+(р-р, ст.с) + DG0обр HPO42-(р-р, ст.с, гип.недис) –
– DG0обр H2PO4- (р-р, ст.с, гип.недис) = 0 + (–1083,2) – (–1124,3) = 41,1 кДж.
Затем определяем константу диссоциации:
DG0 = –RTlnKравн = –RTlnKдис(2)
Кдис(2) = .
.
Пример 2. Стандартная энтальпия образования NaCl (к) равна –411,1 кДж/моль, энтальпия растворения этого соединения в воде с образованием бесконечно разбавленного раствора равна 3,6 кДж/моль, а стандартная энтальпия образования аниона хлора в водном растворе составляет –167,1 кДж/моль. Определить стандартную энтальпию образования иона Na+.
Решение. Ключом к нахождению искомой величины является положение, что стандартная энтальпия образования NaCl в растворе равна сумме стандартных энтальпий образования ионов Na+ и Сl– в растворе. Первая же величина, в свою очередь, равна сумме стандартных энтальпий образования NaCl (к) и энтальпии его растворения с образованием бесконечно разбавленного раствора. Таким образом:
DH0обр NaCl (р-р, ст.с) = DH0обр Na+ (р-р, ст.с) + DH0обр Cl- (р-р, ст.с) =
= DH0обр NaCl (к) + DH0раств;
DH0обр Na+ (р-р, ст.с) = DH0обр NaCl (к) + DH0раств – DH0обр Cl- (р-р, ст.с) =
= –411,1 + 3,6 – (–167,1) = –240,4 кДж/моль.
Пример 3. По следующим данным:
DH0обр NaCl (р-р, ст.с) = –407,5 кДж/моль = DH01;
DH0обр KCl (р-р, ст.с) = –419,4 кДж/моль = DH02;
DH0обр NaBr (р-р, ст.с) = –361,8 кДж/моль = DH03;
DH0обр NaI (р-р, ст.с) = –295,6 кДж/моль = DH04.
определить DH0обрKBr (р-р, ст.с); DH0обрKI (р-р, ст.с).
Решение. Поскольку стандартные энтальпии образования электролитов в растворе тождественно равны сумме стандартных энтальпий образования составляющих их ионов, можно записать:
DH0обрKCl (р-р, ст.с) – DH0обрNaCl (р-р, ст.с) = DH0обрK+ (р-р, ст.с) +
+ DH0обрCl– (р-р, ст.с) – DH0обрNa+ (р-р, ст.с) – DH0обрCl– (р-р, ст.с) =
= DH0обрK+ (р-р, ст.с) – DH0обрNa+ (р-р, ст.с)
Складываем эту величину c DH0обрNaBr (p-p, ст.с) и получаем:
DH0обрK+ (р-р, ст.с) – DH0обрNa+ (р-р, ст.с) + DH0обрNaBr (р-р, ст.с) =
= DH0обрK+ (р-р, ст.с) – DH0обрNa+ (р-р, ст.с) + DH0обрNa+ (р-р, ст.с) +
+ DH0обрBr– (р-р, ст.с) = DH0обрKBr (р-р, ст.с)
Находим одну из искомых величин:
DH0обрKBr (р-р, ст.с) = DH02 – DH01 + DH03 = –419,4 – (–407,5) + (–361,8) =
= – 373,7 кДж/моль.
Аналогично определяем DH0обрKI (р-р, ст.с):
DH0обрKCl (р-р, ст.с) – DH0обрNaCl (р-р, ст.с) + DH0обрNaI (р-р, ст.с) =
= DH0обрK+ (р-р, ст.с) – DH0обрNa+ (р-р, ст.с) + DH0обрNa+ (р-р, ст.с) +
+ DH0обрI–(р-р, ст.с) = DH0обрKI (р-р, ст.с) = DH02 – DH01 + DH04 =
= –419,4 – (–407,5) + (–295,6) = – 307,5 кДж/моль.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 903; Нарушение авторских прав?; Мы поможем в написании вашей работы!