
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие диссоциации электролитов. Пример 1. Константа диссоциации муравьиной кислоты 1,70×10–4
|
|
|
|
Пример 1. Константа диссоциации муравьиной кислоты 1,70×10–4. Найти концентрацию ионов водорода и степень диссоциации кислоты в ее 1 М растворе.
Решение. В соответствии с уравнением диссоциации кислоты:
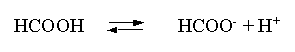
записываем выражение для константы диссоциации:
Кдис = 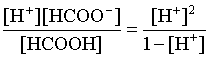 .
.
Концентрация ионов водорода существенно меньше единицы и ею можно пренебречь. Находим концентрацию ионов водорода:
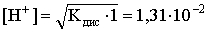 .
.
Наконец, определяем степень диссоциации кислоты:
 или 1,31 %.
или 1,31 %.
Пример 2. Степень диссоциации слабой одноосновной кислоты в 0,1 М растворе составляет 0,1 %. Найти концентрацию ионов водорода в ее 1 М растворе.
Решение. Для нахождения константы диссоциации кислоты воспользуемся соотношением
Кдис = 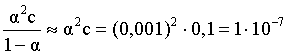 .
.
В соответствии с уравнением диссоциации кислоты
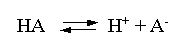
константа диссоциации связана с концентрацией ионов водорода следующим образом:
Кдис =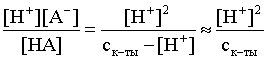
Определяем концентрацию ионов водорода в 1 М растворе:
 моль/л.
моль/л.
Пример 3. В 1 л 0,1 М раствора уксусной кислоты растворили 4,48 л (н.у.) хлороводорода. Как изменилась при этом степень диссоциации уксусной кислоты? Принять объем окончательного раствора равным 1 л, константа диссоциации уксусной кислоты составляет 1,75×10–5.
Решение. Определим степень диссоциации уксусной кислоты в исходном растворе:

Кдис = 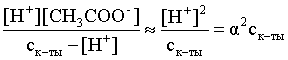
 .
.
В соответствии с уравнением диссоциации появление в растворе сильной хлороводородной кислоты приведет к резкому смещению равновесия диссоциации уксусной кислоты влево. Пусть концентрация ионов водорода, образующихся за счет собственной диссоциации уксусной кислоты равна Х моль/л, такова же концентрация и ацетат-анионов; общая концентрация ионов водорода в растворе составит (X + 0,2) моль/л (4,48 л хлороводорода составляют 0,2 моль). Подставляем эти величины в выражение для константы диссоциации и находим X:
Кдис =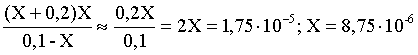 .
.
Определяем степень диссоциации уксусной кислоты в окончательном растворе:
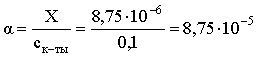 .
.
Таким образом, введение в раствор 0,2 моль хлороводорода привело к уменьшению степени диссоциации уксусной кислоты в:
 раз.
раз.
Пример 4. Константы ступенчатой диссоциации сероводородной кислоты составляют 9,74×10–8, 1,36×10–13. Найти концентрации ионов Н+, HS– и S2–
в 0,01 М растворе этой кислоты.
Решение. В соответствии с уравнением диссоциации H2S по первой ступени
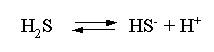
определяем концентрацию ионов Н+ и HS– :
Кдис(1) = 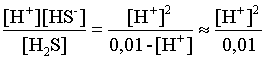 ;
;

Диссоциация по второй ступени

протекает в значительно меньшей степени за счет подавления ее продуктами диссоциации по первой ступени и большей трудности отрыва протона от аниона по сравнению с нейтральной молекулой. Пусть концентрация анионов серы в растворе равна Х моль/л, концентрация ионов водорода составит (X + 3,12×10–5) моль/л, а концентрация ионов HS– – (3,12×10–5 – X) моль/л. Подставляем эти величины в выражение для второй константы диссоциации:
Кдис(2) = .
.
Таким образом, концентрация аниона серы практически равна значению второй константы диссоциации кислоты.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2383; Нарушение авторских прав?; Мы поможем в написании вашей работы!