
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие диссоциации воды, буферные растворы. Вода диссоциирует крайне незначительно в соответствии с уравнением:
|
|
|
|
Вода диссоциирует крайне незначительно в соответствии с уравнением:

Для простоты вместо иона гидроксония будем писать негидратированный ион, так как это не влияет на последующие выводы:

Пользуясь термодинамическими данными и помня, что концентрация индивидуального жидкого вещества равна единице, находим термодинамическую константу обсуждаемого равновесия
DG0процесса = DG0обрH+(р-р,ст.с) + DG0обрOH-(р-р,ст.с) – DG0обрH2O(ж) =
= 0 – 157,32 – (–237,25) = 79,93 кДж;
Кравн= 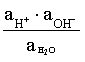 = [H+][OH–]= KW – ионное произведение воды. (3.17)
= [H+][OH–]= KW – ионное произведение воды. (3.17)
Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентрации ионов Н+ и ОН– в воде составляют 1×10–7 моль/л. В 1 л воды, имеющей массу 1000 г, содержится 1000/18 = 55,5 моль воды. Следовательно, отношение недиссоциированных молекул к диссоциированным составляет 55,5/10–7 = 555000000. Иными словами, из 555 миллионов молекул воды диссоциирует лишь одна! В соответствии с (3.17) ионное произведение воды при 298,15 К равно:
КW = 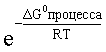 =
= 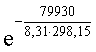 = 1,0×10–14;
= 1,0×10–14;
[H+][OH–]=1,0×10-14 . (3.18)
Логарифмируем выражение (3.18) и меняем знаки в обеих частях уравнения:
lg[H+] + lg[OH–] = – 14;
–lg[H+] – lg[OH–] = 14.
В учебной и научной литературе для выражения маленьких величин используют отрицательную десятичную логарифмическую шкалу:
рК = – lg К (читается "пе ка").
В соответствии с этим вводим величины рН и рОН, определяемые как:
pH = –lg[H+]; pOH = –lg[OH–]. (3.19)
Возвращаясь к предыдущим выкладкам, получаем, что для любого водного раствора при 298,15 К:
рН + рОН = 14. (3.20)
В воде в соответствии с уравнением ее диссоциации соответственно рН = рОН =7, это нейтральная среда. В кислых растворах [H+] >10–7 моль/л и рН<7 (рОН>7). В щелочных растворах [H+]<10–7 моль/л и рН>7 (рОН<7).
Получить растворы с большой концентрацией кислоты не представляет труда, например, H2SO4 и HNO3 неограниченно растворимы в воде и можно приготовить их водные растворы практически любой молярной концентрации. Однако с ростом концентрации кислоты уменьшается степень ее диссоциации и реальных системах получить растворы с концентрацией ионов водорода, большей 10 моль/л, практически невозможно. Учитывая это, получаем интервал изменения величин рН:
–1 < рН < 15. (3.21)
Растворы с постоянным значением рН, не зависящим от разбавления и слабо зависящим от небольших добавок сильных кислот и оснований, называются буферными. Буферные растворы на кислую область – смеси растворов слабых кислот и их солей. Буферным раствором на щелочную область является смесь водного раствора аммиака (NH4ОН) и солей аммония.
Продемонстрируем свойства буферного раствора на примере смеси уксусной кислоты и ацетата натрия. Уравнения диссоциации электролитов:
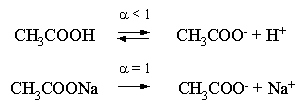
Диссоциация слабого электролита, уксусной кислоты, будет за счет диссоциации ацетата натрия подавлена так, что концентрация ацетат-иона будет практически полностью создаваться за счет диссоциации соли, а концентрация недиссоциированной уксусной кислоты фактически равна общей концентрации кислоты. Выражение для константы равновесия диссоциации уксусной кислоты:
Кдис= 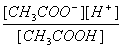 » [H+]
» [H+] 
Отсюда концентрация ионов водорода составляет:
[H+]» Кдис (3.22)
(3.22)
Как видно из (3.22), при разбавлении буферного раствора водой концентрации кислоты и соли синхронно уменьшаются в одинаковое число раз, а их отношение, а значит и концентрация ионов водорода, останется неизменным. Добавление в буферную смесь нескольких капель концентрированного раствора НСl приведет к небольшому увеличению концентрации уксусной кислоты и уменьшению концентрации соли,
а значение дроби с кислоты/ с соли изменится мало. Аналогичная ситуация будет и при добавлении в буферную смесь нескольких капель концентрированного раствора едкого натра – несколько уменьшится концентрация уксусной кислоты и возрастет концентрация соли, а отношение с кислоты/ с соли изменится мало.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1218; Нарушение авторских прав?; Мы поможем в написании вашей работы!