
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы систематического хода анализа катионов. 2 страница
|
|
|
|
Коэффициенты активности ионов f при различных ионных силах раствора
| Ионная сила раствора I | Заряд иона z | Ионная сила раствора I | Заряд иона z | ||||
| ±1 | ±2 | ±3 | ±1 | ±2 | ±3 | ||
| 0,05 0,1 0,2 | 0,84 0,8 | 0,50 0,44 0,41 | 0,21 0,16 0,14 | 0,3 0,4 0,5 | 0,81 0,82 0,84 | 0,42 0,45 0,50 | 0,14 0,17 0,21 |
Если пользоваться значениями активности, то законы химического равновесия можно применять и к сильным электролитам. При этом можно получить значения констант диссоциации сильных кислот. В выражении константы диссоциации вместо концентраций ионов и недиссоциированных молекул будут стоять их активности. В табл.3 приведены константы диссоциации некоторых сильных кислот, выраженные через активности.
Таблица 3
Константы диссоциации некоторых сильных кислот в водных растворах при 25 °С
| Кислота | Формула | Константа диссоциации К |
| Азотная Бромоводород Йодоводород Марганцовая Серная Хлороводород | HNO3 HBr HI HMnO4 H2SO4 HCl | 43,6 К1 = 1000; К2=10ˉ2 |
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты. Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием
солей;
б) способность взаимодействовать с некоторыми металлами
с выделением водорода;
в) способность изменять цвета индикаторов, в частности, вызывать
красную окраску лакмуса;
г) кислый вкус.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т. е. чем больше ее константа диссоциации, тем она сильнее.
Основания. Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием солей;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка:
Zn (OH)2 + 2НС1 = ZnCl2 + 2Н2О
а при взаимодействии с гидроксидом натрия — цинкат натрия:
Zn (OH)2 + 2NaOH = Na2ZnО2 + 2Н2О
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами или амфотерными электролитами. К таким гидроксидам относятся также гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой
H++ROˉ ← ROH → R+ + OHˉ
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль. При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н+.. Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
NaHCO3 = Na+ + НСО ˉ3
НСОˉ3 = Н+ + СОˉ3
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОНˉ. Например, при растворении хлорида гидроксомагния диссоциации протекает согласно уравнениям:
MgOHCl = MgOH+ + Сlˉ
MgOH+= Mg2+ + ОНˉ
Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. Кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли аммония, хотя в его составе нет групп ОН. Например:
NH3 + НСl = NH4 Cl
К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г
Согласно протонной теории, кислотой является донор протона, т. е. частица (молекула или ион), которая способна отдавать ион водорода — протон, а основанием — акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Основание + Протон →Кислота
Связанные этим соотношением основание и кислота называются сопряженными. Например, ион HSOˉ4 является основанием, сопряженным кислоте Н2SО4. Реакцию между кислотой и основанием протонная теория представляет схемой:
(кислота)1 + (основание)2 = (кислота)2 + (основание)1
Например, в реакции
НС1 + NH3 → NH+ 4 + Сlˉ
ион С1ˉ — основание, сопряженное кислоте НС1, а ион NH+ 4 — кислота, сопряженная основанию NH3.
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду NH3—Н2О — HF эта энергия максимальна для NH3 и минимальна для HF. Поэтому в смеси с NH3 вода функционирует как кислота, а в смеси с HF — как основание:
NH3+ Н2О = NH+ 4 + ОНˉ
НF + Н2О = Fˉ + Н3О+
Ионно-молекулярные уравнения.
НСI + NaOH = NaCl + Н2О
HNO3 + КОН = KNO3 + Н2О
Реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу — к образованию молекул воды из ионов водорода и гидроксид-ионов.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением
Н+ + ОНˉ ↔ Н2О
Однако, как мы увидим ниже, вода — очень слабый электролит и диссоциирует лишь в ничтожно малой степени. Иначе говоря, равновесие между молекулами воды и ионами сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца. Это и есть ионно-молекулярное уравнение реакции.
При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой ее соли всегда образуется характерный белый творожистый осадок хлорида серебра:
AgNO3 + НС1 = AgCl↓ + HNO3
Ag2SO4 + CuCl2 = 2AgCl↓ + CuSO4
Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме, а вещество, находящееся в осадке, в молекулярной:
Ag+ + NOˉ 3 + Н+ + Сlˉ = AgCl↓ + Н+ + NOˉ 3
Как видно, ионы Н+ и NOˉ3 не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение еще раз:
Ag+ + Сlˉ → AgCl↓
Это и есть ионно-молекулярное уравнение рассматриваемого процесса. Вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования AgCl из ионов практически доходит до конца.
Для составления ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие нерастворимы. Общая характеристика растворимости в воде важнейших солей приведена в табл. 4
Таблица 4
Растворимость важнейших солей в воде
| Анионы и катионы | Растворимость солей |
| NOˉ 3 Clˉ SO2ˉ 4 CO2ˉ 3 PO3ˉ 4 Na+, K+, NH+ 4 | Растворимы все соли Растворимы все соли, кроме AgNO3, CuCl, PbCl2 Hg2Cl2 Растворимы все соли, кроме BaSO4, SrSO4, PbSO4; малорастворим CaSO4 Из средних солей растворимы только соли натрия, калия и аммония То же Растворимы почти все соли |
Аналитическая химия - лекция №3
Аналитические реакции катионов III - VI аналитических групп. Групповые реагенты, условия их применения. Систематический ход анализа катионов
Катионы III аналитической группы
К III АГ принадлежат катионы щелочноземельных металлов Ва2+, Sr2+,Ca2+. Групповым реагентом является раствор 1 моль/л H2SO4 в присутствии этилового спирта, который обеспечивает оса-ждение катиона Ca2+ в виде сульфата, снижая его растворимость. Катионы II АГ также осаждаются в виде сульфатов и мешают отделению катионов III АГ, в связи с чем их предварительно отделяют. Катионы IV-VI АГ не осаждаются H2SO4 и остаются в растворе. Для катионов III АГ не характерны реакции окисления- восстановления, т.к. они имеют постоянную степень окисления. Большинство соединений этих катионов белого цвета, а растворы бесцветны. Действие некоторых реагентов, а также схема систематического хода анализа катионов III АГ приведены ниже.
Катионы IV аналитической группы.
К IV АГ принадлежат катионы Al3+, Zn2+, Cr3+, Sn2+, Sn (IV), As(III), As (V). Групповым реагентом является раствор 6 моль/л NaOH вместе с 3% Н2О2. Под действием группового реагента сна-чала выпадают осадки гидроксидов, которые растворяются в из-бытке NaOH. Присутствие Н2О2 способствует образованию гид-роксо- и оксоанионов этих элементов в наивысших степенях оки-сления. При этом катионы V и VI АГ осаждаются в виде гирок-сидов, а гидроксо- и оксоанионы IV АГ остаются в растворе.
Катионы V аналитической группы
К V АГ принадлежат катионы Fe2+,Fe3+,Mg2+,Mn2+,Bi3+, Sb3+, Sb5+
Групповым реагентом является концентрированный раствор аммиака, который осаждает данные катионы в виде гидроксидов, нерастворимых в избытке реагента, за исключением гидроксидов Sb3+ и Sb5+ Дальнейший ход анализа катионов V АГ основывается на разной растворимости гидроксидов этих катионов в концентрированных солях аммония, кислотах, а также на использовании различных ОВР. Соединения Fe3+ желто-бурого цвета, а Fe2+ светло-зеленого, соединения других катионов – белые, а их растворы – бесцветные.
Катионы VI аналитической группы
К VI АГ принадлежат катионы Cu2+, Hg2+, Co2+, Ni2+ для которых характерны реакции комплексообразования. Большинство соединений VI АГ хорошо растворяются в воде (сульфаты, хлориды, нитраты, ацетаты и др.) Нерастворимы в воде - гидроксиды, карбонаты, фосфаты. Групповым реагентом на VI АГ является концентрированный раствор аммиака, который образует с данными катионами растворимые аммиачные комплексы. Дальнейший ход анализа катионов VI АГ основывается на разрушении этих комплексов действием 6 моль/л H2SO4, осаждении сульфидов Cu+ и Hg2+ и разной растворимости этих сульфидов в азотной кислоте и бромной воде. Все катионы VI АГ окрашены (за исключением Hg2+) и образуют окрашенные соединения.
Действие некоторых реагентов на катионы III аналитической группы
Ва2+, Sr2+,Ca2+
| Реагент | Катионы | ||
| Ва2+ | Sr2+ | Ca2+ | |
| H2SO4 | BaSO4 белый осадок, не растворяется в кислотах и щелочах | SrSO4 белый осадок, не растворяется в кислотах и щелочах | CaSO4 белый осадок, частично растворяется в воде. Растворяется в концентрированном растворе (NH4)2SO4 |
| насыщенный раствор CaSO4 (гипсовая вода) | BaSO4 белый осадок, образуется быстро | SrSO4 белый осадок, образуется постепенно при нагревании | _____ |
| Na2CO3, K2CO3, (NH4)2CO3 | ВаСО3 белый осадок, растворяется в сильных кислотах и уксусной кислоте | SrCO3 белый осадок, растворяется в сильных кислотах и уксусной кислоте | СаСО3 белый осадок, растворяется в сильных кислотах и уксусной кислоте |
| K2CrO4 | BaCrO4 желтый осадок, растворяется в сильных кислотах, не растворяется в уксусной кислоте | SrCrO4 желтый осадок, растворяется в сильных кислотах и в уксусной кислоте | _____ |
| (NH4)2C2O4 | BaC2O4 белый осадок, растворяется в сильных кислотах, не растворяется в уксусной кислоте | SrC2O4 белый осадок, растворяется в сильных кислотах, не растворяется в уксусной кислоте | CaC2O4 белый осадок, растворяется в сильных кислотах, не растворяется в уксусной кислоте |
Действие некоторых реагентов на катионы IV аналитической группы
AsO3ˉ3, AsO3ˉ4, Al3+
| Реагент | Катионы | ||
| As(III) AsO3ˉ3 | As(v) AsO3ˉ4 | Al3+ | |
| KOH или NaOH | - | - | Al(OH)3 белый осадок, растворяется в избытке реагента |
| H2O2 в щелочной среде | AsO3ˉ4 бесцветный раствор | AsO3ˉ4 бесцветный раствор | [Al(OH)6]3ˉ бесцветный раствор |
| K4[Fe(CN)6] | - | - | - |
| CH3COONa | - | - | Al(OH)2CH3COO белый осадок, растворяется в кислотах и щелочах |
| HgCl2 | - | - | - |
| Zn, HCl | AsH3 газ с характерным запахом | AsH3 газ с характерным запахом | - |
| Дитизон в CCl4 или в CHCl3 | - | - | - |
| Ализарин | - | - | «Алюминиевый лак», осадок ярко-красного цвета |
| Na2B4O7 * 10H2O | - | - | - |
Действие некоторых реагентов на катионы IV аналитической группы
| Реагент | Катионы | |||
| Cr3+ | Zn2+ | Sn2+ | Sn(IV) [SnCl6]2ˉ | |
| KOH или NaOH | Cr(OH)3 зеленый осадок, растворяется в избытке реагента | Zn(OH)2 белый осадок, растворяется в избытке реагента | Sn(OH)2 белый осадок, растворяется в избытке реагента | Sn(OH)4 белый осадок, растворяется в избытке реагента |
| H2O2 в щелочной среде | CrO2ˉ4 желтый раствор | [Zn(OH)4]2ˉ бесцветный раствор | [Sn(OH)6]4ˉ бесцветный раствор | [Sn(OH)6]2ˉ бесцветный раствор |
| K4[Fe(CN)6] | K2Zn3[Fe(CN)6]2 белый осадок, растворяется в HCl | Sn2[Fe(CN)6] белый осадок, растворяется в HCl | Sn2[Fe(CN)6] белый осадок, растворяется в HCl | |
| CH3COONa | - | - | - | - |
| HgCl2 | - | - | Hg черный осадок | - |
| Zn, HCl | - | - | - | - |
| Дитизон в CCl4 или в CHCl3 | - | Цинк дитизонат. Раствор ярко- красного цвета | - | - |
| Ализарин | - | - | - | - |
| Na2B4O7 * 10H2O | Cr(BO2)3 изумрудно-зеленая жемчужина | - | - |
Схема систематического хода анализа катионов V аналитической группы
Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb(III), Sb(V)
Этапы исследования
1. Определение Fe(II), Fe(III) ионов в отдельной пробе с реагентами K3[Fe(CN)6] и K4[Fe(CN)6] соответственно:
Fe2+ K3[Fe(CN)6] Fe3[Fe(CN)6]2↓
Fe3+ K4[Fe(CN)6] Fe4[Fe(CN)6]3↓
2. Отделенение Sb(III) и Sb(V) ионов действием HNO3 и Н2О2:
Sb(III), Sb(V) HNO3; H2O2 HSbO3↓
3. Растворение осадка № 2 в растворе HCl:
HSbO3↓ HCl [SbCl6]ˉ
4. Определение Sb(V) катиона в растворе № 3 действием цинка на никелевой пластине:
[SbCl6]ˉ Zn Sb↓
5. Осаждение катионов V аналитической группы из центрифугата №2 действием концентрированного раствора NH3 * H2O:
Mg2+ NH3 * H2O Mg(OH)2↓
Mn2+ NH3 * H2O Mn(OH)2↓
Fe3+ NH3 * H2O Fe(OH)3↓
Bi3+ NH3 * H2O BiONO3↓
6. Отделение Mg2+ катионов действием на осадок №5 насыщенным раствором NH4Cl и 3% раствором Н2О2:
Mg(OH)2↓ NH4Cl Mg2+
7. Определение Mg2+ катиона в центрифугате № 6 действием Na2HPO4 в присутствии аммиачного буферного раствора:
Mg2+ Na2HPO4, NH3 *H2O+NH4Cl MgNH4PO4↓
8. Отделение Bi3+ и Fe3+ катионов действием раствора HNO3 на осадок № 6:
BiONO3↓ HNO3 Bi3+
Fe(OH)3↓ HNO3 Fe3+
9. Растворение осадка MnO2 * nH2O, полученного по п. 8, действием раствора HNO3 в присутствии Н2О2:
MnO2*nH2O↓ HNO3; H2O2 Mn2+
10. Определение Mn2+ катиона действием на раствор № 9 (NH4)S2O8:
Mn2+ (NH4)S2O8; HNO3; AgNO3 MnOˉ4
11. Определение Bi3+ катиона в центрифугате №8 действием свежеприготовленного [Sn(OH)6]4ˉ:
Bi3+ [Sn(OH)6]4ˉ Bi↓
Действие некоторых реагентов на катионы VI аналитической группы
Cu2+, Hg2+, Co2+, Ni2+
| Реагент | Катионы | |||
| Cu2+ | Hg2+ | Co2+ | Ni2+ | |
| NaOH или KOH | Cu(OH)2 голубой осадок | Hg(OH)2 белый осадок, разлагается до HgO. Желтый осадок. | Co(OH)Cl синий осадок | Ni(OH)2 зеленый осадок |
| Осадки растворяются в кислотах и в избытке раствора аммиака | ||||
| Основные соли и амидные соединения | ||||
| NH3 * H2O без избытка | Cu(OH)2SO4↓ и др. зеленый | NH2HgCl↓ белый | Co(OH)Cl↓ и др. синий | (NiOH)2SO4↓ и др. зеленый |
| Осадки растворяются в избытке реактива | ||||
| NH3 * H2O в избытке | [Cu(NH3)4]2+ - синий | [Hg(NH3)4]2+ бесцветный | [Co(NH3)6]2+ оранжево-коричневый | [Ni(NH3)6]2+ сиреневый |
| Разрушаются кислотами | ||||
| Na2S2O3 | Cu2S↓ черный + S↓ растворяется в HNO3 | HgS черный, растворяется в бромной воде | - | - |
| KI | CuI белый + +I2 бурый | HgI2 оранжево-красный, растворяется в избытке реагента | - | - |
| (NH4)2NCS | Cu(NCS)2↓ черный, который постепенно превращается в белый CuNCS↓ | Hg(NCS)2↓ белый, растворимый в избытке реагента с образованием [Hg(NCS)4]2ˉ бесцветный | (NH4)2[Co(NCS)4] синий цвет | - |
| SnCl2 | Cu↓ | Hg↓ | - | - |
Схема систематического хода анализа катионов VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+
Этапы исследования
1. Взаимодействие катионов VI аналитической группы с групповым реагентом (избыток NH3*H2O):
Cu2+ изб.NH3*H2O [Cu(NH3O)4]2+
Hg2+ изб.NH3*H2O [Hg(NH3O)4]2+
Co2+ изб.NH3*H2O [Co(NH3O)6]2+
Ni2+ изб.NH3*H2O [Ni(NH3O)6]2+
2. Разрушение аммиакатов действием 2 моль/дм3 H2SO4
3. Отделение Cu2+ и Hg2+ ионов от других катионов VI
аналитической группы действием Na2S2O3 на раствор №2:
Cu2+ Na2S2O3;Δ Cu2S↓ + S↓
Hg2+ Na2S2O3;Δ HgS↓
4. Отделение Cu2S от HgS при частичном растворении осадка №3 в разб. HNO3 при нагревании:
Cu2S↓ HNO3;Δ Cu2+
5. Определение Cu2+ ионов в растворе №4 действием
концентрированного NH3 * H2O:
Cu2+ NH3*H2O [Cu(NH3)4]2+
6. Растворение осадка № 4 действием бромной воды в присутствии HCl или в «царской водке»:
HgS↓ Br;HCl [HgCl2] + S↓
HgS↓ конц.HNO3,конц. HCl [HgCl2]
7. Отделение [HgCl2] от S↓ центрифугированием.
8. Определение Hg2+ ионов в центрифугате №7 действием раствора SnCl2:
[HgCl2] SnCl2 Hg↓
9. Определение Co2+ ионов в центрифугате №3 действием раствора NH4NCS в присутствии амилового спирта:
Co2+ NH4NCS (NH4)2[Co(NCS)4]
C5H11OH
10. Определение Ni2+ ионов в центрифугате №3 действием реактива Чугаева (диметилглиоксима):
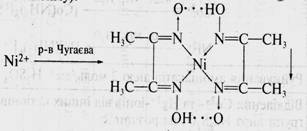
Схема систематического хода анализа катионов III аналитической группы Ba2+, Sr2+, Ca2+
Этапы исследования
1. Осаждение катионов III аналитической группы действием 1 моль/дм3 H2SO4 в присутствии C2H5OH при нагревании:
Ba2+ H2SO4, Δ BaSO4↓
Sr2+ H2SO4, Δ SrSO4↓
Ca2+ H2SO4, C2H5OH, Δ CaSO4↓
Промывание осадка водой, которая содержит H2SO4
2. Переосаждение осадков сульфатов катионов III аналитической группы в осадки их карбонатов действием насыщенного раствора Na2CO3 при кипячении:
BaSO4↓ Na2CO3, Δ BaCO3↓
SrSO4↓ Na2CO3, Δ SrCO3↓
CaSO4↓ Na2CO3, Δ CaCO3↓
Промывание осадка водой
3. Растворение осадка №2 действием раствора СН3СООН:
BaCO3↓ СН3СООН Ba2+
SrCO3↓ СН3СООН Sr2+
CaCO3↓ СН3СООН Ca2+
4. Выявление Ba2+ катиона в отдельной порции раствора №3 действием раствора K2CrO4:
Ba2+ K2CrO4 BaCrO4↓
Если присутствие Ba2+ катиона доказано, то его извлекают из раствора №3 действием раствора K2CrO4
5. Выявление Sr2+ катиона в отдельной порции центрифугата №4 действием насыщенного раствора кальция сульфата (гипсовая вода):
Sr2+ насыщ. раствор CaSO4 SrSO4↓
гипсовая вода
6. Удаление Sr2+ катионов из центрифугата №4 действием конц. раствора (NH4)2SO4:
Sr2+ конц. (NH4)2SO4 SrSO4↓
Ca2+ конц. (NH4)2SO4 [Ca(SO4)2]2ˉ
7. Выявление Ca2+ катиона в центрифугате № 6 действием раствора (NH4)2С2O4:
Ca2+ (NH4)2С2O4 СаС2О4↓
СН3СООН
Схема систематического хода анализа катионов IV аналитической группы
Al3+, Zn2+, Cr3+, Sn2+, Sn (IV), As(III), As (V)
Этапы исследования
1. Выявление As (III), As (V) ионов в отдельной пробе действием металлического цинка в среде HCl:
As(III), (V) Zn, НCl AsH3↑
Бумага, пропитанная AgNO3 AsH3↑ Ag↓ (черный)
(реакция Гутцайта)
Бумага, пропитанная [HgCl2] AsH3↑ AsH2(HgCl)↓
(Реакция Зангер-Блека) AsH(HgCl)2↓
As(HgCl)3↓
As2Hg3↓
(желто-коричневый)
2. Действие избытка 6 моль/дм3 NaOH в присутствии Н2О2 на катионы IV аналитической группы при нагревании:
Al3+ NaOH Al(OH)3↓избыток NaOH[Al(OH)6]3ˉ
Cr3+ NaOH Cr(OH)3↓ избыток NaOH,H2O2,Δ CrO2ˉ4
Sn2+ NaOH Sn(OH)2↓ избыток NaOH, H2O2, Δ[Sn(OH)6]2ˉ
Sn(IV) NaOH Sn(OH)4↓ избыток NaOH [Sn(OH)6]2ˉ
As(III) NaOH AsO3ˉ3 H2O2, Δ AsO3ˉ4
As(V) NaOH AsO3ˉ4 H2O2, Δ AsO3ˉ4
3. Отделение гидроксоанионов [Al(OH)6]3ˉ; [Sn(OH)6]2ˉ из раствора №2 действием кристаллического NH4Cl при нагревании:
[Al(OH)6]3ˉ NH4Cl,Δ Al(OH)3↓
[Sn(OH)6]2ˉ NH4Cl,Δ Sn(OH)4↓
4. Растворение осадка №3 действием 2 моль/дм3 HCl:
Al(OH)3↓ HCl Al3+
Sn(OH)4↓ HCl [SnCl6]2ˉ
5. Выявление Al3+ катиона действием на раствор №4 ализарина или натрия ацетата:
Al3+ ализарин, NaOH
Al3+ CH3COONa Al(OH)2CH3COO↓
6. Выявление Sn(IV) действием раствора соли меркурий (II) – катионов на прокипяченный с железными в среде HCl раствор №4:
[SnCl6]2ˉ Fe, HCl; Δ Sn2+ HgCl2 Hg↓
7. Выявление Zn2+ - катиона в центрифугате №3 действием раствора дитизона, или K4[Fe(CN)6]:
Действие некоторых реагентов на катионы V аналитической группы
| Реагент | Катионы | ||||||
| Bi3+ | [SbCl6]3ˉ | [SbCl6]ˉ | |||||
| NaOH; KOH | Bi(OH)3 белый осадок | Sb(OH)3 белый осадок | HSbO3 белый осадок | ||||
| Растворяются в HCl | |||||||
| Растворяются в щелочах | |||||||
| NH4OH | BiONO3 или BiOCl белый осадок, растворяется в кислотах | Sb(OH)3 белый осадок | HSbO3 белый осадок | ||||
| Na2HPO4 + NH4OH | BiPO4 белый осадок, не раст-ся в уксусной к-те и разведенной азотной кислоте | Белые осадки основных солей переменного состава | |||||
| HNO3, H2O2 | HSbO3 Белые осадки, которые растворяются в HCl и щелочах | ||||||
| Реагент | Катионы | ||||||||
| Fe2+ | Fe3+ | Mg2+ | Mn2+ | ||||||
| NaOH; KOH | Fe(OH)2 зеленый осадок | Fe(OH)3 красно-бурый осадок | Mg(OH)2 белый осадок | Mn(OH)2 белый осадок, который становится бурым на воздухе вследствие образования MnO * nH2O | |||||
| Осадки растворяются в кислотах и в растворе NH4Cl (кроме Fe(OH)3) | |||||||||
| NH4OH | Fe(OH)2 зеленый осадок | Fe(OH)3 красно-бурый осадок | Mg(OH)2 белый осадок | Mn(OH)2 белый осадок, который становится бурым на воздухе вследст образования MnO * nH2O | |||||
| Na2HPO4 + NH4OH | Fe3 (PO4)2 | FePO4 | MgNH4PO4 | Mn3 (PO4)2 | |||||
| Белые осадки, растворяются в минеральных кислотах, не растворяются в уксусной кислоте | |||||||||
| HNO3, H2O2 | - | - | - | - | |||||
Аналитическая химия - лекция №5
Анионы. Классификация. Характерные реакции анионов. Особые случаи и систематический ход анализа анионов при совместном присутствии.
Анионы, в отличие от катионов, можно определять в отдельных порциях раствора дробными реакциями в любой последователь-ности. Но для упрощения анализа их, как и катионы, делят на аналитические группы. В большинстве классификаций разделение анионов основано на разной растворимости солей бария и серебра соответствующих анионов.
I АГ анионов: S2O2ˉ3, SO2ˉ4, SO2ˉ3, CrO2ˉ4, Cr2 O2ˉ7 С2O2ˉ4, CO2ˉ3, F ˉ, PO3ˉ4, AsO3ˉ4, SiO2ˉ3 и др.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 877; Нарушение авторских прав?; Мы поможем в написании вашей работы!