
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Крива рівноваги на трикутній діаграмі
|
|
|
|
Процеси змішування в трикутній діаграмі, правило важіля
При змішуванні двох трикомпонентних розчинів складів R і Е (рис. 10.4.1,б) утворюється потрійна суміш, склад котрої характеризується точкою N, яка лежить на прямій RE, яка з'єднує вихідні склади. Положення точки N на прямій знаходять по правилу ричага, якщо відомо кількості взятих розчинів R і Е
(кількість R)/( кількість E) = EN/RN (11.5.1)
Звідки випливає, що якщо суміш N будь-яким методом розкласти на дві фракції R і Е, то точки R, Е і N, які відповідають цим трьом сумішам, повинні лежать на прямій RNE. Якщо відомо кількість суміші N, її склад і склади фракцій після розділення суміші, то легко знайти кількість цих фракцій по виразам:
(кількість R)/ (кількість N) = EN/(RN+EN) = EN/RE (11.5.2)
(кількість Е)/( кількість N) = RN/(RN+EN) = RN/RE (11.5.3)
Трикутна діаграма (рис.10.6.1) може бути використана для зображення рівноваги в потрійних системах координат рідина - речовини, що розподіляється - рідина. Аби отримати уявлення про рівновагу в потрійних системах, розглянемо процес додавання речовини М, що розподіляється, до гетерогенної суміші двох розчинників L і G. Нехай речовина М, що розглядається, необмежено розчиняється в обох розчинниках L і G, а самі розчинники L і G мають обмежену взаємну розчинність.
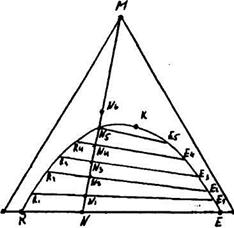
Рис. 11.6.1. Крива рівноваги на трикутній діаграмі.
З трикутної діаграми, яку представлено на рис.11.6.1, видно, що якщо М і L а також М і G утворюють однорідні двокомпонентні розчини, склад котрих характеризується точками на сторонах діаграм LМ і GM, то розчинним L і G утворюють однорідні розчини лише на невеликих ділянках LR і EG. Будь-яка суміш розчинників на ділянці RE розшаровується на два однорідних двокомпонентних насичених розчина R (насичений розчин G в L) і Е (насичений розчин L в G). Кількість насичених розчинів в кожному з двох шарів, що утворилися, залежить від положення точки N, яка виражає середній склад двофазної системи, і може бути визначена по правилу ричага з виразів (11.5.1) - (11.5.3).
При додаванні речовини М, що розподіляється, в суміш склaду N отримуємо потрійну суміш, склад котрої характеризується точкою N1, яка лежить на прямій змішyвання NM. Суміш складу N1 розшаровується на дві фази з рівноважними складами R1 (фаза розчинника L) і Е1 (фаза розчинника G) в кількісному співвідношенні E1N1:R1N1.
При додаванні в суміш наступних порцій М2, М3,... отримаємо ряд потрійних сумішей
складу N2, N3,.... котрі, як видно в попередньому випадку, розшаровуються на рівноважні
потрійні суміші складу R2 і Е2, R3 і Е3 і т.д. Як видно з діаграми, змінюються і вагові
співвідношення рівноважних розчинів до моменту, коли одна з фаз щезає (в нашому випадку при N5). При ще більшому розвeденні компонентом, що розподіляється, маємо лише однорідні потрійні розчини складу N6 і інші.
З'єднавши R1 і Е1, R2 і E2,... лініями, отримаємо хорди рівноваги R1 E1, R2 Е2 які з'єднують на діаграмі рівноважні склади. Хорди рівноваги, зменшуючись, сходяться в точці К, яка зветься критичною.
З'єднавши точки, які відповідають рівноважним складам, плавною кривою RR1R2... К... Е2Е1Е, отримаємо криву рівноваги, або так звану бінодальну криву, одна гілка RK котрої характеризує рівноважні склади фази розчинника L, а друга ЕК - рівноважні склади фази розчинника G.
Бінодальна крива на трикутній діаграмі обмежує площу, яка відповідає двофазним сумішам; площа діаграми поза кривою відповідає однофазним розчинам. Для процесу екстракції цікавість являє лише зона двофазних розчинів.
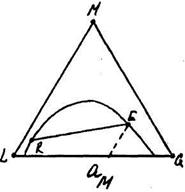
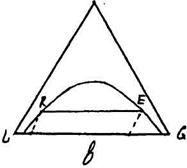
По трикутній діаграмі легко знайти коефіцієнт розподілення ψ для будь-якої пари рівноважних розчинів. Так як для двох розчинів R і Ε (рис. 11.6.2) коефіцієнт розподілення ψ дорівнює:
ψ = (концентрація М в фазі F)/(концентрація М в фазі R) (11.6.1)
причому величина ψ може бути більше одиниці (рис. 11.6.2,а), менше одиниці (рис. 11.6.2,б) або рівна одиниці (рис. 11.6.2,в).

ψ>1 ψ<1 ψ=1
Рис. 11.6.2. До розрахунку коефіцієнта розподілення.
Нахил хорди рівноваги визначається природою компонентів і складом фаз.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 276; Нарушение авторских прав?; Мы поможем в написании вашей работы!