
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівняння і лінії рівноваги
|
|
|
|
Звичайно при розрахунках масообмінних процесів фактичні або робочі концентрації розподіляючої між фазами речовини задні. Аби знайти напрям процесу і його швидкість, необхідно знати рівноважні концентрації при робочих умовах, або залежність рівноважних концентрацій у * розподіляючої речовини в одній фазі від робочої концентрації х в іншій, тобто
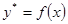 ; (7.3.1)
; (7.3.1)
наприклад,
 ; (7.3.2)
; (7.3.2)
де m і n - величини, що визначаються дослідним шляхом.
Значення m залежить від фізико-хімічних властивостей системи, від температури, тиску, а часто і від концентрації розподіляючої між фазами речовини. Тому на діаграмі в координатах У - Х лінії рівноваги, які описуються залежностями (7.3.1) або (7.3.2) можуть мати вигляд кривих (Рис. 7.3.1,а.)
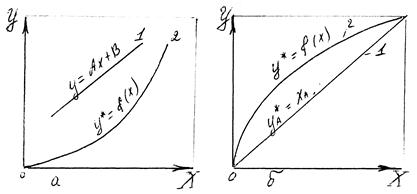
Рис.7.3.1.Фазові діаграми Y-X:
а – за рівнянням (7.3.2); б - за рівнянням (7.3)
1 – робоча лінія; 2 – лінія рівноваги.
Для ідеальних систем (наприклад, розчинів) рівняння ліній рівноваги відомі. Наприклад, для ідеального розчину, якщо його температура вище критичної температури розчиняючого газу, використаємо закон Генрі, по котрому парціальний тиск розчиненого пропорційний його молярній долі в розчині:
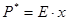 ; (7.3.3)
; (7.3.3)
де p* - парціальний тиск поглинаючого газу над розчином, що знаходиться в рівновазі, при концентрації розчину х; Е - константа Генрі.
Із закона Дальтона
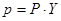 (7.3.4)
(7.3.4)
Тоді
 (7.3.5)
(7.3.5)
де Р загальний тиск в системі.
Значення m в рівнянні (7.3.5) залежить від загального тиску і від температури. З ростом температури m збільшується, при цьому розчинність; зі збільшенням загального тиску значення m знижується, що призводить до збільшення розчинності газу.
При постійній температурі і тиску залежність між рівноважними значеннями у і робочими х виражається графічно прямою лінією, що проходить через початок координат, з кутом нахилу, тангенс котрого рівний m.
Закон Генрі виконується для ідеальних розчинів. Для реальних розчинів він використовується з достатньою точністю лише при сильному розбавленні. Для систем, які не підчиняються цьому закону, значення m в рівнянні (7.3.5) є змінною величиною і лінія рівноваги являє собою криву, котру будують звичайно по дослідним даним.
Якщо температура ідеального розчину менше критичної температури, тобто відбувається конденсація газу то система підпорядковується закону Рауля, котрий можна отримати, спів ставивши вирази для хімічного потенціалу.
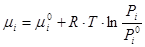

при умові рівності хімічних потенціалів:
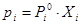 (7.3.6)
(7.3.6)
З виразу (7.2.8) випливає, що парціальний тиск пару I – того компоненту над розчином рівно добутку тиску пару чистого компоненту (тобто тиск насиченого пару цього компоненту) при температурі розчину на йог мольну долю в рідкій фазі.
Для двохкомпонентної суміші складу А-В вираз (7.3.4) і (7.3.6) дають зв’язок між робочими і рівноважними концентраціями:
 (7.3.7)
(7.3.7)
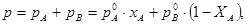
Звідки
 .
.
Розділивши останній вираз на  і позначивши
і позначивши  через
через 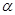 (де
(де 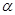 - відносна летучість компонентів), отримаємо
- відносна летучість компонентів), отримаємо
 (7.3.8)
(7.3.8)
Це рівняння є рівняння кривої лінії.
Часто приходиться користуватися експериментальними даними, так як закони розподілення отримані для ідеальних систем.
Знаючи рівноважні і робочі концентрації, можна знайти напрям процесу: з якої фази і в яку буде приходити розподіляюча між фазами речовина. Вважаємо, що співвідношення між робочими і рівноважними концентраціями відповідають (Рис.7.3.1,а). Якщо  , речовина переходить з фази 1 в фазу 2 при цьому
, речовина переходить з фази 1 в фазу 2 при цьому 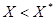 . Якщо
. Якщо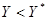 (при цьому
(при цьому 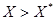 ), перехід речовини буде зворотнім – 3 фази 2 в фазу 1. Таким чином, розподіляємо між фазами речовина в точці контакту фаз переходить в ту фазу, робоча концентрація котрої менше рівноважної.
), перехід речовини буде зворотнім – 3 фази 2 в фазу 1. Таким чином, розподіляємо між фазами речовина в точці контакту фаз переходить в ту фазу, робоча концентрація котрої менше рівноважної.
Крім того, знання різниці рівноважних і робочих концентрацій дозволяє визначити рушійну силу переносу маси, що необхідно для розрахунку швидкості прррроцесу масопереносу.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 445; Нарушение авторских прав?; Мы поможем в написании вашей работы!