
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутрішня енергія системи. Фізичні основи термодинаміки
|
|
|
|
Фізичні основи термодинаміки
Термодинаміка вивчає властивості тіл і явищ природи, не цікавлячись їх мікроскопічною структурою. В основі термодинаміки лежать кілька фундаментальних законів, які виведені шляхом узагальнення великої сукупності експериментальних даних.
Підходячи до зміни стану речовини з різних точок зору (молекулярна фізика з мікроскопічного рівня, термодинаміка – з макроскопічного), вони взаємно доповнюють одна одну.
Система. Системою будемо називати сукупність тіл, що розглядається. Будь-яка система може знаходитися у різних станах. Величини, що характеризують стан системи, називаються параметрами стану. Так, газ має три параметри стану – тиск Р, об’єм V і температуру Т.
Рівноважний стан. Якщо всі параметри системи визначені, то такий стан системи називається рівноважним. Будь-який рівноважний стан може бути зображений на координатній площині точкою.
Рівноважний процес – це процес, що складається з неперервної послідовності рівноважних станів. Рівноважним може бути тільки нескінченно повільний процес. Тільки рівноважні процеси на координатній площині можуть бути зображені відповідною кривою.
Важливою характеристикою термодинамічної системи є її внутрішня енергія U- енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер, тощо) і енергія взаємодії цих часток. До внутрішньої енергії не належить кінетична енергія системи як цілого і потенціальна енергія системи у зовнішніх полях. Внутрішня енергія –однозначна функція термодинамічного стану системи. В ідеальному газі немає сил взаємодії між молекулами, отже, дорівнює нулю взаємна потенціальна енергія молекул. Тому для моля ідеального газу внутрішня енергія дорівнює сумі кінетичних енергій NA молекул.
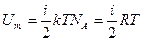 (2.11)
(2.11)
Якщо є 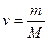 молів газу,то його внутрішня егнергія
молів газу,то його внутрішня егнергія
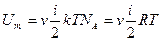 (2.12)
(2.12)
Внутрішня енергія ідеального газу залежить від кількості ступенів вільності молекул і абсолютної температури газу.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!