
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ентропія
|
|
|
|
Із нерівності Клаузіуса випливає, що сума зведених кількостей теплоти, отриманих системою при оборотному переході з одного стану в інший, не залежить від шляху, за яким виконується перехід, а залежить тільки від початкового і кінцевого станів (рис.2.15):
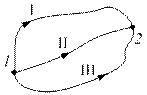
Рис. 2.15
 . (2.44)
. (2.44)
Звідси випливає, що при оборотному переході величина 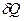 /T є приростом деякої функції стану. Ця функція позначається S і називається ентропією системи:
/T є приростом деякої функції стану. Ця функція позначається S і називається ентропією системи:
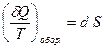 . (2.45)
. (2.45)
Таким чином, ентропія – це функція стану системи, приріст якої при оборотному процесі дорівнює зведеній кількості теплоти, отриманої системою:
 , (2.46)
, (2.46)
де S1 – значення ентропії у початковому стані, S2 – у кінцевому.
Фізичний зміст ентропії випливає із статистичного визначення ентропії, яке вивів Больцман:
S = k lnW, (2.47)
де k – стала Больцмана; W – термодинамічна ймовірність системи, що характеризує кількість різних способів, якими може бути реалізований даний стан системи.
Властивості ентропії. З урахуванням необоротних процесів формула (2.44) переписується у вигляді нерівності
 , (2.48)
, (2.48)
де знак рівності береться для оборотних процесів, а нерівності – для необоротних. Для ізольованої системи
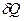 =0 і d S³ 0.
=0 і d S³ 0.
З цього випливає, що: 1) ентропія ізольованої системи тільки збільшується, якщо процеси в ній необоротні (закон збільшення ентропії); 2) ентропія ізольованої системи залишається сталою, якщо процеси в ній оборотні (закон збереження ентропії).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 435; Нарушение авторских прав?; Мы поможем в написании вашей работы!