
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Материалы и оборудование
|
|
|
|
Лабораторно - практическое занятие № 15.
Лабораторно - практическое занятие № 14
Лабораторно - практическое занятие № 13.
Лабораторно - практическое занятие № 12
Лабораторно - практическое занятие № 11.
Лабораторно- практическое занятие № 10.
Лабораторно- практическое занятие № 9
Лабораторно - практическое занятие № 8.
Лабораторно- практическое занятие № 7
Лабораторно- практическое занятие № 6.
Лабораторно- практическое занятие № 5
Лабораторно- практическое занятие № 4
Лабораторно- практическое занятие № 3.
Лабораторно- практическое занятие № 2
Лабораторно- практическое занятие № 1
Методические указания для выполнения лабораторных работ по микробиологии
Где
Еi – экономическая эффективность компоненты ИАСУ;
Кс = f(kj, aj) – системный коэффициент;
kj – частные значения
показателей интеграции по одному из направлений интеграции
всех компонент ИАСУ;
aj – коэффициент предпочтительности показателя.
Степень интеграции можно определить с помощью метода
экспертных оценок по всем аспектам интеграции: функциональному, организационному, математическому, информационному и
техническому. Коэффициенты предпочтительности могут быть
определены из некоторой шкалы оценок, найденной по всем видам интеграции также с помощью информации, полученной от
экспертов. Недостаток данного подхода — субъективизм в определении большого числа различных коэффициентов, входящих в указанные выше уравнения, что влечет за собой значительное разногласие при определении окончательного значения
экономической эффективности (например, на стадии внедрения
ИАСУ). Сложность и комплексный подход в проектировании и
эксплуатации ИАСУ настоятельно требуют разработки новых
методик расчета экономической эффективности ИАСУ на основе выявления не только уже найденных, но и "скрытых" источников эффективности. Разработка совершенных методик позволит также устранить имеющиеся противоречия между организа-
зззззциями-разработчиками ИАСУ и пользователями.
Тема: Микробиологическая микробиология. Микроскопы. Устройство микроскопа.
Цель занятия: Ознакомиться с техникой безопасности при работе в микробиологической лаборатории. Правила работы с микроскопом. Изучить разновидности световой микроскопии: темнопольная, фазово - контрастная, люминесцентная.
Правила по технике безопасности при работе в микробиологической лаборатории.
1. Не входить в лабораторию в пальто, головном уборе, не вносить посторонние вещи.
2. Приступать к занятиям, надев хлопчатобумажный халат.
3. Строго соблюдать правила обращения с химическими реактивами и красителями.
4. С большой осторожностью пользоваться смесью спирта с эфиром, не переносить ее на столы с горелками.
5. Поскольку некоторые микроорганизмы, особенно споры грибов, являются аллергенами, не допускать их распыления — не оставлять открытыми чашки Петри, пробирки, колбы с культурами микроорганизмов.
6. Перед тем как набирать ртом с помощью пипетки суспензии микроорганизмов или реактивы, убедиться в том, что пипетка закрыта с тупого конца ватой.
7. В лаборатории поддерживать порядок и чистоту. По окончании занятий протирать иммерсионный объектив микроскопа мягкой тканью, накрывать микроскоп полиэтиленовым чехлом, приводить в порядок рабочее место, мыть руки.
8. Помнить о том, что студенты несут ответственность за используемые ими микроскопы, другое лабораторное оборудование, чистоту рабочего места.
9. Перед уходом из лаборатории дежурному проверять, выключены ли газ, вода, электроприборы.
Микроорганизмы можно обнаружить только при помощи оптического или электронного микроскопа. Максимальное увеличение оптического микроскопа составляет 3000. Это позволяет различать частицы размером не менее 0,1—0,2 мкм1. Современные электронные микроскопы имеют разрешающую способность до 0,15 нм2, что дает возможность видеть не только мельчайшие организмы, но и тонкие структуры клеток. Подобный микроскоп увеличивает рассматриваемый объект в 750 000 раз.
Микроскопия в темном поле. В основе метода лежит эффект Тиндаля — рассеивающийся пучок света при наблюдении сбоку имеет вид голубоватого конуса на темном фоне. Другими словами, при освещении объекта косыми лучами света эти лучи, не попадая в объектив, остаются невидимыми для глаза, поэтому поле зрения выглядит темным. В то же время оптически неоднородные клетки, находящиеся в поле зрения и попадающие в сферу прохождения лучей, отклоняют их в такой степени, что лучи попадают в объектив. Поскольку лучи света идут именно от объектов, наблюдатель видит их в темном поле интенсивно светящимися. Метод используется при исследовании живых клеток микроорганизмов.
Микроскопия с фазово-контрастным устройством. Глаз человека различает световые волны по длине (цвет) и амплитуде (интенсивность, контрастность), но не различает их по фазе.
Метод фазово-контрастной микроскопии разработан для наблюдения за прозрачными объектами. Он основан на преобразовании фазовых изменений, претерпеваемых световой волной при прохождении через объект, в видимые амплитудные с помощью определенного оптического устройства.
Для проведения исследований необходимо в дополнение к световому микроскопу иметь фазово-контрастное устройство (наиболее широко распространена модель КФ-4), которое состоит из фазовых объективов (на оправе имеется буква «Ф»), конденсоров с набором кольцевых диафрагм и вспомогательного микроскопа (оптического устройства, помещаемого в тубус вместо окуляра при установке фазового контраста). Метод применяют для исследования живых клеток микроорганизмов, контрастность которых достигается оптическим путем без вмешательства в их физиологические процессы.
Люминесцентная, или флуоресцентная, микроскопия. Некоторые биологические объекты способны при освещении коротковолновыми лучами (сине-фиолетовыми, ультрафиолетовыми) поглощать их и испускать лучи с более длинной волной. При этом клетки будут светиться желто-зеленым или оранжевым светом. Это собственная, или первичная, люминесценция.
Нелюминесцирующие объекты можно обработать специальными флуоресцирующими красителями — флуорохромами (акридином желтым, акридином оранжевым, аурамином, примулином, тиофлавином, конго красным) и также наблюдать люминесценцию. Это будет наведенная, или вторичная, люминесценция. Препараты, окрашенные флуорохромами, изучают в средах, не люминесцирующих под действием коротковолновых лучей: в воде, глицерине, вазелиновом масле или физиологическом растворе.
Люминесцентная микроскопия по сравнению с обычной позволяет:
- сочетать цветное изображение и контрастность объектов;
- изучать морфологию живых и мертвых клеток микроорганизмов в питательных средах и тканях животных и растений;
- исследовать клеточные микроструктуры, избирательно поглощающие различные флуорохромы, являющиеся при этом специфическими цитохимическими индикаторами;
- определять функционально-морфологические изменения клеток;
- использовать флуорохромы при иммунологических реакциях и подсчете бактерий в образцах с невысоким их содержанием.
Электронная микроскопия. По схеме строения электронный микроскоп аналогичен световому, но освещение объекта обеспечивает не луч света, а поток электронов от вольфрамовой нити, нагреваемой электрическим током. Разрешающая способность современных электронных микроскопов составляет 0,2—0,4 нм, рабочее увеличение в среднем - 100 000 раз.
Трансмиссионный электронный микроскоп. Трансмиссионный (от лат. transmissio — передача, переход) микроскоп широко применяют в биологических исследованиях. Каждый электронный микроскоп состоит из электронной пушки (источник электронов); электромагнитных катушек, выполняющих роль конденсорной, объективной и проекционной линз; предметного столика; экрана для изображения и окуляра. Для работы микроскопа необходим вакуумный насос, так как движение электронов возможно только в вакууме. Электроны в трансмиссионном микроскопе движутся по такому же пути, как и лучи света в световом микроскопе.
При изучении под электронным микроскопом морфологических особенностей клеток микроорганизмов исследуются целые клетки, для изучения ультраструктуры клеток — их срезы. Толщина срезов не должна превышать 0,8—0,9 мкм.
Сканирующий, или растровый, электронный микроскоп. Этот микроскоп дает объемное, почти трехмерное изображение исследуемого объекта. В сканирующих микроскопах подвижный тонкий электронный луч очень быстро и последовательно обегает поверхность исследуемого объекта по квадратному растру и передает полученную информацию на электронно-лучевую трубку, покрытую люминофором, светящимся под действием электронов. Глубина фокуса сканирующего микроскопа достигает нескольких миллиметров; пределы полезного увеличения — 10—15 тыс. раз, разрешающая способность меньше, чем у трансмиссионных электронных микроскопов.
Препараты для сканирующего микроскопа подвергают специальной обработке, основная цель которой — обезвоживание объекта без нарушения (сморщивания) поверхности структур. Затем препарат покрывают тонким слоем сплава золота или платины, что делает его поверхность электропроводной и позволяет избежать накопления электрического заряда, который может снизить разрешающую способность микроскопа.
Контрольные вопросы:
1. Порядок выполнения работ в микробиологической лаборатории.
2. Строение светового микроскопа.
3. Правила работы с микроскопом.
4. Виды микроскопии.
Тема: Морфология микроорганизмов.
Цель занятия: Ознакомить студентов с размерами и формами прокариотных клеток, морфологией актиномицетов, миксобактерий, спирохет, нитчатых форм бактерий и микоплазм.
Под общим понятием «бактерии» описано свыше 1600 видов микроорганизмов - прокариот, не имеющих настоящего сложноорганизованного ядра. Большинство представителей бактерии — одноклеточные организмы, различающиеся размерами и физиологическими свойствами. По форме все бактерии можно разделить на шаровидные (или кокки), палочковидные, извитые и нитчатые.
Шаровидные бактерии — кокки (от греч. kokkos — зерно, шарик). Они делятся на следующие группы.
1. Микрококки (от лат. micro — маленький). В природе встречаются в виде одиночных шаровидных клеток. Примером могут служить клетки Mikrococcus agilis (от лат. agilis — подвижный).
2. Диплококки (от греч. diploos — двойной)— шаровидные бактерии, соединенные по двое. К ним относится Аzotobacter chroococcum. Родовое название этих бактерии отражает их способность фиксировать азот атмосферы, видовое — продуцировать коричневый пигмент (от лат. chroo — коричневеющий).
3. Стрептококки (от греч. streptos — цепь) — шаровидные бактерии, образующие в результате деления клеток в одной плоскости разнообразной длины цепочки. К роду стрептококков относятся в основном патогенные бактерии. Но стрептококковую форму имеют многие молочнокислые бактерии рода лактококкус. Поэтому с этой формой бактерий знакомятся при изучении молочнокислого брожения на примере Lactococcus lactis. Родовое и видовое названия этих бактерий, образующих короткие цепочки, отражают их причастность к молочнокислому брожению (от лат. lactis — молочный).
4. Сарцины (от лат. sarceo — соединяю) — шаровидные бактерии, группирующиеся по 8 клеток. Располагаются в виде куба, с каждой стороны которого по 4 клетки. Такая форма возникает в результате деления клетки в трех взаимно перпендикулярных плоскостях. Некоторые виды сарцин формируют большие сарциноподобные кубообразные пакеты, в которых с каждой стороны находится уже не по 4 клетки (субъединицы сарцины), а по 4 сарцины. Удобна для просмотра Sarcina flava (сарцина желтая) — наиболее распространенный представитель микрофлоры воздуха.
Все шаровидные формы бактерий, за исключением Lactococcus lactis, просматривают на фиксированных и окрашенных фуксином препаратах.
Палочковидные бактерии. К ним относят формы, образующие споры (роды Bacillus, Clostridium и др.) и не образующие их (роды Pseudomonas, Achromobacter, Lactobacillus и др.).
С представителями палочковидных бактерий, образующих споры, можно познакомиться на примере Bacillus mycoides или Bacillus mesentericus. В названии первого вида отражена его способность развиваться на питательных средах в виде ложно-грибовидного налета (от лат. mycoides — грибовидный), напоминающего мицелий грибов.
Поскольку Bacillus mycoides - спорообразующая палочка, цитоплазма клетки, приступившей к спорообразованию, прокрашивается красителем, а спорогенная зона — нет.
Нитчатые формы. Представляют собой цепочки цилиндрических клеток, часто окруженные общим влагалищем, или чехлом. Нитчатые бактерии распространены в илах, почве и водоемах, особенно с высоким содержанием железа. В водоемах эти бактерии часто образуют охристые осадки.
Извитые формы. 1. Вибрионы (от лат. vibrare — извиваться, дрожать) — слегка изогнутые клетки: изгиб их меньше половины окружности.
2. Спириллы (от лат. spiro — штопор). В отличие от вибрионов их клетки более длинные, толстые и извитые: извитость или равна, или больше половины окружности. Спириллы могут иметь один завиток в виде русской букны С, два завитка в виде латинской буквы S или несколько — в виде спирали.
3. Спирохеты — длинные и тонкие клетки с большим количеством мелких, но крутых завитков; длина клеток превышает их толщину в 5—200 раз.
Миксобактерии, или скользящие бактерии. Это группа бактерий, стоящая на более высокой ступени эволюционного развития, чем описанные выше. У отдельных представителей миксобактерии (Sorangium, Polyangium) даже в световой микроскоп четко видно дифференцированное ядро. Вегетативные клетки имеют палочковидную форму с заостренными или округлыми концами. По мере старения они укорачиваются и переходят в миксоспоры, соединяющиеся впоследствии слизью и образующие первичные и вторичные цисты. Из последних в дальнейшем формируются плодовые тела.
Актиномицеты (от греч. aktis — луч, mykes — гриб) — лучистые грибы. Эта группа микроорганизмов занимает промежуточное положение между бактериями и грибами, поэтому ее представителей называют грибобактериями. Они одноклеточные, как бактерии, но образуют мицелий, как грибы; диаметр нитей у них очень мал, как у бактерий (не более 0,5— 0,8 мкм), но гифы мицелия длинные и ветвистые, как у грибов. У актиномицетов длина ветвящихся нитей достигает нескольких миллиметров, мицелий грибов в длину — нескольких сантиметров. С грибами актиномицетов объединяет также способность размножаться спорами.
Эта группа микроорганизмов занимает промежуточное положение между бактериями и грибами, поэтому ее представителей называют грибобактериями. Они одноклеточные, как бактерии, но образуют мицелий, как грибы; диаметр нитей у них очень мал, как у бактерий (не более 0,5— 0,8 мкм), но гифы мицелия длинные и ветвистые, как у грибов. У актиномицетов длина ветвящихся нитей достигает нескольких миллиметров, мицелий грибов в длину — нескольких сантиметров. С грибами актиномицетов объединяет также способность размножаться спорами.
На питательных средах актиномицеты образуют пушистые, бархатистые, мучнистые, преимущественно плотные кожистые колонии, срастающиеся с субстратом, иногда имеющие характерный землистый запах. Мицелий актиномицетов на питательных средах дифференцирован: одна часть его погружена в субстрат (субстратный мицелий), другая находится над субстратом (воздушный мицелий).
Многие представители актиномицетов продуцируют пигменты, поэтому их воздушный мицелий и особенно колонии окрашены в голубой, синий, фиолетовый, розовый, бурый, коричневый или черный цвета. Актиномицеты, образующие диффундирующие в питательную среду пигменты, окрашивают ее в соответствующие цвета.
Много общего с актиномицетами имеют нокардии, или проактиномицеты.
|
|
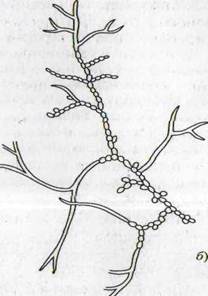
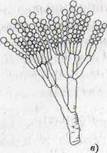
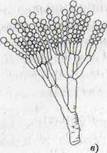
Рисунок 1- Актиномицеты (а); нокардии (б); микобактерии (в)
Нокардии. Это наименее дифференцированные формы актиномицетов. Воздушный мицелий у них отсутствует или развит слабо. На питательных средах развиваются колонии тестообразной (мягкой) консистенции с характерным мицелиальным ободком. Окраска их также разнообразна, как и у нокардиеформных актиномицетов. В молодом возрасте проактиномицеты образуют мицелий, который вскоре начинает септироваться (в нитях образуются перегородки) и расчленяться на палочковидные фрагменты, в дальнейшем переходящие в укороченные палочки, но чаще – в кокки.
Микобактерии. Это палочковидные, иногда ветвящиеся, образующие подобие мицелия бактерии. Настоящего мицелия микобактерии не имеют. Колонии тестообразной консистенции, продуцируют пигмент. В молодой культуре формируются палочки искривленной формы с неровным контуром - звездообразные, иногда довольно длинные, с боковыми отростками. В старых культурах ветвистые палочки часто распадаются сначала на более короткие палочки, затем на кокки.
Контрольные вопросы:
1. Морфологические виды бактерий.
2. Перечислите типы шаривидных бактерий.
3. На какие группы делятся палочковидные бактерии?
4. Где встречаются нитчатые бактерий?
5. Каких представителей миксобактерий вы знаете?
6. Особенности морфологии актиномицетов.
7. Дайте характеристику нокардиям и микобактериям.
Тема: Морфология грибов.
Цель работы: Ознакомить студентов с основными представителями микроскопических грибов.
Объектами микробиологии служат многие виды микроскопических грибов. Грибы относят к эукариотам. Тело гриба состоит из мицелия, или грибницы, — сплетения тонких ветвящихся нитей — гиф.
Зигомицеты. Низшие грибы, имеют хорошо развитый ветвистый одноклеточный мицелий. Размножаются как половым путем, так и бесполым, т.е. при помощи спор.
Представитель класса — мукор (Мuсог mucedo) развивается в виде войлочного белого или серого налета на продуктах растительного происхождения и навозе травоядных животных. Мицелий мукоровых грибов пронизывает субстрат и частично стелется по его поверхности. Вверх от грибницы отходят особые воздушные гифы — спорангиеносцы, вздувающиеся на концах.
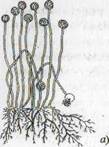
|
|

|
|

|

|
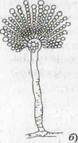
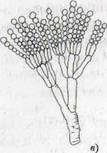
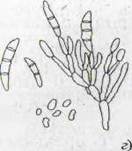
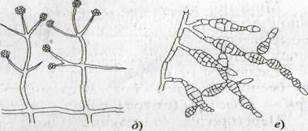
Рис. 2. Грибы микроскопические: а – Мисоr, б — Aspergellus, в - Penicillium, г - Fusarium, конидиеносец с конидиями: 1 — макроконидии, 2 — микроконидии; д — Trichoderma, конидиеносцы с головками конидий; е — Altenaria, конидиеносцы с цепочками конидий
Аскомицеты, или сумчатые грибы. Высшие грибы с многоклеточным или членистым мицелием, образующие споры в сумках— асках. Они включают представителей эуаскомицетов (истинных аскомицетов), у которых сумки со спорами формируются в результате полового процесса внутри плодовых тел, и гемиаскомицетов, у которых плодовые тела отсутствуют. Эуаскомицеты включают два важнейших рода почвенных грибов Penicillium и Aspergillus, которых нередко называют также плесневыми грибами. Пенициллы и аспергиллы имеют хорошо развитый многоклеточный мицелий. Размножаются преимущественно конидиальным спороношением. Наблюдаются в виде налета голубого, зеленого, сизого, реже других цветов на продуктах растительного происхождения (варенье, томатной пасте, лимонах и апельсинах), отсыревших изделиях из кожи, обоях. Распространены в верхних горизонтах почвы.
У мукора головки гладкие — «лысые», так как споры его эндогенного происхождения (внутренние), а у аспергилла и пеницилла — экзогенные споры (внешние).
Дейтеромицеты, или несовершенные грибы. Имеют многоклеточный мицелий, но у них нет полового процесса и совершенной стадии спороношения. Размножаются бесполым путем при помощи конидий или вегетативно участками гифов. В природе широко распространены представители родов Fusarium, Trichoderma, Alternaria, которых формально относят к дейтеромицетам. Встречаются они на растительных остатках, плодах, семенах и в почве.
Среди грибов рода Fusarium есть сапротрофы, живущие в почве и на растительных остатках, и паразиты, вызывающие заболевания многих видов растений (увядание, гнили корней, стеблей, плодов, полегание сеянцев древесных и кустарниковых пород, болезни семян, различные пигментации органов растений).
Грибы рода Trichoderma нередко можно обнаружить на коре, древесине, засохших листьях и стеблях, а также на семенах различных трав, кустарников и деревьев. Обладая антибиотическими свойствами в отношении других грибов, в том числе паразитических, триходерма выполняет оздоровляющую функцию в почве.
Разные виды рода Alternaria можно выделить с листьев пораженных этим грибом растений картофеля или томата, с семян капусты и других растений, из почвы.
Дрожжи. По современным представлениям, дрожжи — это сборная группа одноклеточных микроскопических организмов, относящихся к разным классам грибов, преимущественно — к классу аскомицетов.
Диаметр клеток дрожжей колеблется от 8 до 15 мкм. Форма их разнообразна: эллипсовидная, грушевидная, округлая, цилиндрическая. Размножаются вегетативным и половым путем. Вегетативные способы размножения— почкование и деление; половой способ размножения связан с образованием спор. К почкующимся дрожжам относятся представители «культурных» дрожжей рода Saccharomyces (сахаромицеты) - Форма их разнообразна. Размножаются они почкованием (вегетативный способ размножения) и аскоспорами. При почковании на материнской клетке возникает маленькая выпуклость — почка — дочерняя клетка, в которую переходит одно ядро. Клетка увеличивается в размерах и отделяется. Если условия для такого размножения благоприятны (достаточное количество сахара, соответствующая температура, аэрация), процесс идет очень быстро. К делящимся — виды рода Schizosaccharomyces (шизосахаромицеты) – возбудители спиртового брожения. При половом процессе слияние вегетативных клеток ведет к образованию сумок со спорами. В каждой сумке образуется от 2 до 8, иногда 12 спор. Среди дрожжей есть аспорогенные, ложные дрожжи, не способные к половому процессу и спорообразованию. Они относятся к классу несовершенных грибов.
Контрольные вопросы:
1. На какие группы делятся грибы?
2. Перечислите классы истинных грибов.
3. Представителями каких классов являются дрожжи?
4. Типы размножения грибов.
5. Представителями каких классов грибов являются возбудители корневой гнили растений?
6. Особенности сумчатых грибов в отличии от представителей других классов?
7. Перечислите часто встречаемых представителей дейтеромицетов.
Тема: Морфология вирусов.
Цель работы: Ознакомить студентов со строением и размножением вирусов и бактериофагов.
Название вирус (в переводе означающее «яд») применяли сначала для обозначения различных малоизученных болезнетворных агентов. Позднее оно закрепилось за группой возбудителей, открытых Ивановским в 1892 году, которые оказались способными проходить через бактериальные фильтры. Их стали называть «фильтрующимися вирусами» или просто «вирусами». Вирусы отличаются от микроорганизмов еще более малыми размерами: они не задерживаются бактериальными фильтрами, не оседают при центрифугировании в обычной центрифуге (а только в ультрацентрифуге) и их нельзя разглядеть в обычный световой микроскоп.
Еще важнее, однако, другие признаки, отличающие вирусы от всех организмов: 1) вирусы содержат нуклеиновые кислоты только какого-нибудь одного типа, ДНК или РНК; 2) для их репродукции необходима только нуклеиновая кислота и 3) они не обладают способностью к росту вне клетки-хозяина и к размножению делением. Таким образом, вирусы не являются самостоятельными организмами; для их репродукции необходимы живые клетки.
Вирусы размножаются в клетке-хозяине, вызывают ее гибель, затем поражают соседние здоровые клетки и таким образом разрушают целые комплексы клеток. Именно по таким очагам поражений в тканях (некрозы), а также по зонам лизиса (пятна, или бляшки) в культуре ткани и на бактериальном газоне распознают присутствие вирусов.
Вирусы, поражающие растения, попадают внутрь растительных клеток через повреждения, а не в результате активного внедрения. Вирусы, патогенные для животных, вызывают у человека и животных ряд болезней: натуральную и ветряную оспу, корь, бешенство, полиомиелит, грипп, ящур и т. д.
Размножение вируса в клетке-хозяине — весьма сложный процесс. Отдельные этапы этого процесса — от заражения клетки-хозяина до освобождения зрелых вирусных частиц, способных в свою очередь произвести заражение — довольно хорошо изучены с биохимической, генетической и морфологической стороны. Подобно другим вирусам, фаги неподвижны. При смешивании суспензии свободных фагов с суспензией бактерий фаговые частицы в результате случайных столкновений с клетками прикрепляются к поверхности этих последних (адсорбция) и вводят в клетку свою ДНК (инъекция). После некоторого периода, на протяжении которого происходят процессы синтеза и созревания, клетки лизируются и новообразованные фаговые частицы выходят наружу.
Не всякий фаг адсорбируется на всякой бактерии. Специфичность фага в отношении хозяина определяется специфичностью адсорбции, которая зависит от рецепторов, имеющихся в клеточной стенке; рецепторы для одних фагов содержатся в липопротеидном слое, для других — в липополисахаридном. Устойчивость некоторых бактерий к фагам зависит, вероятно, оттого, что в их клеточной стенке рецепторные вещества вообще отсутствуют. При избытке фага на одной клетке может адсорбироваться 200 - 300 фаговых частиц.
За адсорбцией следует инъекция, введение ДНК в клетку. У фага при этом базальная пластинка фиксируется на клетке, чехол отростка сокращается и полый стержень (благодаря этому сокращению) входит в клетку. В клетку попадает только нуклеиновая кислота, а белковая оболочка остается снаружи. Если отделить эту оболочку от зараженной клетки, размножение фага не нарушится. Фаговая ДНК прежде всего вызывает полную перестройку обмена веществ инфицированной клетки. Тотчас же после заражения прекращается синтез бактериальной ДНК. Через несколько минут прекращается также синтез бактериальной РНК и бактериального белка, хотя общее содержание белка продолжает непрерывно увеличиваться. Затем синтез ДНК возобновляется, причем с повышенной скоростью. Сначала фаговая ДНК образуется за счет распавшейся бактериальной. Необходимые для синтеза фаговой ДНК ферменты образуются вскоре после заражения. Это так называемые «ранние белки». К «поздним белкам» относятся белки оболочки фага и фаговый лизоцим, или эндолизин; «поздние белки» образуются лишь во второй половине скрытого периода. Заключительный процесс — созревание — состоит в соединении фаговой ДНК с белком оболочки и образовании зрелых инфекционных фаговых частиц.
Бактериофаги неизменно лизируют зараженные ими бактерии, и потому их называют вирулентными. Некоторые фаги, однако, заражают бактерий-хозяев, но не размножаются в них автономно и не вызывают лизиса. Такие фаги называются умеренными. Видимо, их размножение происходит синхронно с размножением бактерии. Фаг в неинфекционном состоянии, передающийся от клетки к клетке, называют профагом. Подобно другим признакам бактерий наличие профага наследуется. Поскольку все потомство лизогенной клетки также лизогенно, очевидно, профаг реплицируется синхронно с хромосомой клетки-хозяина.
Лизогенные бактерии иммунны к заражению теми фагами, которые присутствуют в них в виде профага. Обеспечиваемый профагами иммунитет основывается не на отсутствии адсорбции (как при устойчивости к вирулентным фагам), а на образовании особого цитоплазматического репрессорного вещества, препятствующего размножению вегетативного фага. Это же репрессорное вещество препятствует возврату профага в вегетативное состояние и подавляет синтез фаговых белков. Возникновение лизогенного состояния связано, таким образом, с образованием репрессора.
Спонтанно, без воздействия извне, лизогенные бактерии лизируются редко. Однако целый ряд факторов (ультрафиолетовые лучи и другие мутагенные агенты) может индуцировать в каждой клетке развитие профага, ведущее к образованию и выделению инфекционного фага. Успех такой индукции зависит от генетической конституции профага, физиологического состояния хозяина и условий культивирования. Умеренные фаги могут также переходить в вирулентное состояние в результате мутации
Фаги, как правило, проявляют специфичность в отношении хозяина. Определенный фаг поражает только один штамм бактерий или ограниченное число родственных штаммов, видов или родов; только в их клетках он способен размножаться. Такого рода специфичность обусловливается в первую очередь рецепторными свойствами поверхности бактериальной клетки.Однако, помимо этого, бактерии располагают и еще одной системой для распознавания фагов. Это распознавание зависит от фаговой ДНК. Речь идет о так называемой модификации фаговой ДНК, т. е. о незначительном ее изменении путем метилирования или гликозилирования пиримидиновых или пуриновых колец. Эти процессы происходят уже после образования фаговой ДНК в клетке-хозяине. Незначительное изменение ДНК никак не отражается на заключенной в ней генетической информации. Оно только позволяет клеткам «узнавать» ДНК. Это означает, что судьба такой ДНК в клетках разных бактериальных штаммов оказывается различной: в одних клетках эта ДНК разрушается, а в других — не разрушается и может реплицироваться. Разрушение фаговой ДНК нуклеазами зараженной клетки называют рестрикцией.
Контрольные вопросы:
1. Что такое вирус?
2. Отличие вирусов от других микроорганизмов.
3. Что такое вирулентный фаг?
4. Каково воздействие фагов на лизогенные бактерии?
5. В чем заключается специфичность фагов при адсорбции на бактериях?
6. Какие изменения происходят в бактериальной клетке при попадании в нее фага?
7. Вирусные заболевания растений и животных.
Тема: Методы стерилизации.
Цель работы: Ознакомить студентов с основными методами стерилизации.
Стерилизация, или обеспложивание (от лат. sterilis — бесплодный), — это полное уничтожение клеток микроорганизмов в питательных средах, посуде и пр. Известно несколько методов стерилизации. Чаше всего применяют стерилизацию нагреванием.
Фламбирование, или прокаливание. Прокаливать можно непосредственно перед употреблением платиновые петли, иглы, шпатели, мелкие металлические предметы (ножницы, ланцеты, пинцеты), а также стеклянные палочки, предметные, покровные стекла и т. д.
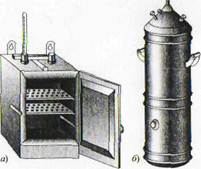
Стерилизация сухим жаром. Ее применяют для обработки посуды и сухих материалов, например крахмала, мела. При этом стерилизуемый объект выдерживают при 170 °С в течение 2 ч (считая с того момента, как установлена необходимая температура) в печи Пастера (рис. 8, а) или в электросушильных шкафах. Поднимать температуру выше 170 °С не рекомендуется: ватные пробки и бумага начинают разрушаться (буреют, становятся ломкими).Перед стерилизацией стеклянную посуду закрывают ватными пробками и обертывают бумагой. Чашки, пробирки, пипетки, вату, марлю заворачивают в бумагу или помещают в особые футляры и пеналы, в которых стерильная посуда может храниться после стерилизации.По окончании стерилизации шкаф открывают только после того, как температура снизится до комнатной, иначе стекло может лопнуть.
Стерилизация текучим паром. Текучим паром (100 °С) обрабатывают предметы, портящиеся от сухого жара, и некоторые питательные среды, не выдерживающие более высокой температуры (среды с углеводами, МПЖ, молоко). Проводят стерилизацию в кипятильнике Коха (рис. 8, б) по 30 мин в течение 3 суток ежедневно. Такая стерилизация называется дробной.
Кипятильник Коха — высокий металлический цилиндр с двойным дном, свободно закрывающийся конусообразной крышкой с отверстием для термометра. Снаружи цилиндр покрыт асбестом или линолеумом. На дно кипятильника наливами воду, устанавливают подставку с отверстиями для прохождения пара, на которую помешают стерилизуемые предметы. Продолжительность стерилизации отсчитывают с момента интенсивного выхода пара из-под крышки и повышения температуры до 100° С.
|
Рис. 3 -Оборудование для стерилизации: а – печь Пастера; б – кипятильник Коха
При однократном прогреве при температуре 100 ° С в течение 30 мин погибают вегетативные клетки, споры же многих микроорганизмов остаются жизнеспособными. После такого прогрева среду помещают на 24 ч в термостат при 28—30 ° С. Споры, сохранившиеся при первом нагревании, успевают за это время прорасти в вегетативные формы, которые погибают при последующем нагревании. Затем эту операцию повторяют еще 2 раза.
Стерилизация насыщенным паром под давлением. Это наиболее быстрый и надежный способ стерилизации, при котором гибнут самые устойчивые споры. С его помощью стерилизуют большинство питательных сред, посуду.Обработку насыщенным паром проводят в герметически закрывающемся толстостенном котле — автоклаве.
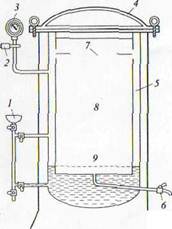 Рисунок- 4. Схема автоклава:
Рисунок- 4. Схема автоклава:
1 - воронка, через которую автоклав заправляют водой
2 - предохранительный клапан;
3 - манометр;
4 - крышка автоклава;
5 - водопаровая камера;
6 - кран для выпуска воздуха;
7 - отверстие, через которое пар поступает
в стерилизационную камеру;
8 - стерилизационная камера;
9 -подставка для размещения стерилизуемых материалов.
На массивной крышке или сбоку котла находятся кран для выхода пара, манометр и предохранительный клапан. Манометр показывает, насколько давление пара внутри котла выше нормального. Для предотвращения взрыва при превышении предельного давления срабатывает предохранительный клапан, давая выход пару.
Надежной стерилизации достигают нагреванием при 120 °С и давлении 1 атм в течение 20 мин. Стерилизацию ведут следующим образом. Наливают воду в автоклав, помешают в него стерилизуемые предметы, завинчивают крышку автоклава и начинают подогрев. Кран оставляют открытым до тех пор, пока весь воздух, находящийся в автоклаве, не будет вытеснен парами воды. Когда пар начнет выходить из крана непрерывной струей, кран закрывают, доводят давление пара в автоклаве до 1 атм и поддерживают на этом уровне 20—30 мин. Затем нагрев прекращают, ждут, пока стрелка манометра опустится до 0, осторожно (понемногу) открывают кран и спускают пар. Только потом отвинчивают крышку автоклава. Если кран открыть раньше, чем упадет давление, то жидкость в стерилизуемых сосудах закипит и вытолкнет из них пробки. Для контроля за работой автоклавов среди стерилизуемых предметов можно закладывать специальные тесты-ампулы, содержащие химические вещества, которые плавятся при определенной температуре. Так, температура плавления бензонафтола 110 °С, антипирина — 113 °С. Автоклав используют и для дробной стерилизации текучим паром. В этом случае крышку не завинчивают, чтобы обеспечить свободный выход пару.
Пастеризация. Пастеризация представляет собой неполную, или частичную, стерилизацию, что означает нагревание при 65—80 °С в течение сответственно 30—10 мин с последующим быстрым охлаждением до 10—11 °С. Прием был предложе Л. Пастером для уничтожения неспорообразующих бактерий в продуктах, чьи свойства ухудшаются при кипячении (молоко, пиво, вино и др.).
Холодная стерилизация — фильтрование через мелкопористые фильтры. Применяют для обработки сред, компоненты которых легко разлагаются при нагревании. Через мелкие поры фильтра могут пройти только ультрамикроорганизмы (вирусы, бактериофаги).Наиболее часто используют фильтры из каолина (полые цилиндры, закрытые с одной стороны). Чтобы жидкость прошла через такой фильтр, необходимо создать разницу давлений по обе стороны цилиндра. Этого достигают нагнетанием или откачиванием воздуха при помощи масляных насосов. Фильтр соединяют с приемником для жидкой среды, которым служит колба Бунзена. Оттянутый конец колбы закрывают ватной пробкой. Смонтированные фильтр с приемником стерилизуют.Среду для стерилизации наливают в сосуд, в который помешают фильтр, а колбу Бунзена с ватной пробкой соединяют с насосом (масляным или водоструйным) и выкачивают воздух. Поскольку внутри фильтра давление стало ниже, чем над его поверхностью, жидкость под давлением проходит через фильтр в приемник. Бактерии остаются с внешней стороны фильтра.Неудобства этого метода заключаются в медленной фильтрации и необходимости частой очистки фильтров.
Контрольные вопросы:
1. Значение методов стерилизации.
2. Каким образом стерилизуют лабораторную посуду?
3. Каким образом стерилизуют лабораторные инструменты?
4. Как нужно стерилизовать питательные среды?
5. Что называют стерилизацией насыщенным паром под давлением?
6. Отличия стерилизации в кипятильнике Коха?
7. Что стерилизуют методом пастеризации?
8. Что такое холодная стерилизация? Каким образом она осуществляется?
Тема: Методы приготовления препаратов микроорганизмов. Цитохимические методы исследования микроорганизмов.
Цель работы: Ознакомить студентов с методами фиксации и окраски.
Техника взятия культуры для приготовления препарата. Пробирку с культурой держат в левой руке почти в горизонтальном положении вблизи горелки. Перед взятием культуры правой рукой вынимают ватную пробку из пробирки, зажимая ее между мизинцем и ладонью, а края пробирки обжигают на пламени горелки. Иглу держат в правой руке большим, указательным и средним пальцами. Обожженной в пламени бактериологической иглой из пробирки берут небольшое количество микробной массы.Если культуру берут из жидкой среды, не следует сильно наклонять пробирку, чтобы не смочить ее края и пробку. Для взятия культуры лучше пользоваться петлей. После взятия культуры края пробирки и пробку обжигают в пламени и закрывают пробирку.
Исследование живых клеток микроорганизмов методами раздавленной и висячей капли. В обоих случаях окрашивание объекта проводят «прижизненными» красителями — витальная окраска. Прижизненными красителями могут служить метиленовый синий, нейтральный красный в концентрациях от 0,001 до 0,0001%.
Оба метода применяют для выявления подвижности клеток микроорганизмов, наблюдения за размножением, образованием и прорастанием спор, установления реакции микроорганизмов на химические соединения и физические факторы воздействия, изучения размеров клеток, характера их расположения, определения запасных веществ в клетке.
В случае использования метода раздавленной капли на чистое предметное стекло наносят каплю водопроводной воды. В нее вносят культуру и смешивают с водой. Накрывают каплю покровным стеклом так, чтобы под ним не образовывались пузырьки воздуха. Стеклянной палочкой прижимают покровное стекло к предметному и удаляют избыток воды фильтровальной бумагой, поднося ее к краям покровного стекла. При просмотре приготовленного препарата под микроскопом с иммерсионным объективом на покровное стекло наносят каплю кедрового масла.
Для длительных наблюдений за клетками микроорганизмов применяют метод висячей капли. Для него требуется специальное предметное стекло с лункой посередине. На стерильное покровное стекло наносят иглой негустую суспензию микроорганизмов, выращенных в жидкой питательной среде или подготовленных для данной цели. Покровное стекло переворачивают и помещают на стерильное предметное стекло с лункой так, чтобы капля свободно свисала в лунку. Для герметичности края лунки смазывают вазелином.
Фиксированные препараты микроорганизмов. Под фиксацией подразумевается такая обработка живого объекта, которая дает возможность быстро прервать течение жизненных процессов в объекте, сохранив его тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях безопасности).
Приготовление мазка. На чистое обезжиренное предметное стекло наносят каплю водопроводной воды. Прокаленной бактериологической иглой из пробирки с культурой берут небольшое количество микробной массы и вносят в каплю воды. Каплю тщательно размазывают петлей по стеклу на плошади около 4 см2. Для этого прокаленной петлей берут немного суспензии и переносят в каплю воды на другое предметное стекло. Суспензию нормальной густоты размазывают тонким слоем по стеклу, затем мазок сушат на воздухе при комнатной температуре или при слабом нагревании, держа препарат высоко над пламенем горелки. Сильное нагревание препарата при сушке не рекомендуется для избежания коагуляции белков, искажающей структуру и форму клеток. Высушенный препарат фиксируют.
Фиксация мазка. Ее проводят над пламенем горелки при исследовании формы клеток или при помощи химических соединений для изучения внутренней структуры клеток. В первом случае препарат три-четыре раза медленно проводят нижней стороной над пламенем горелки. Во втором случае используют хромовые соединения, формалин, осмиевую кислоту, ацетон.
Окрашивание препарата. При окрашивании мазка препарат помещают на препаратодержатель. На мазок наносят несколько капель красителя. В зависимости от вида красителя и цели исследования продолжительность окрашивания варьирует от 1 до 5 мин, в отдельных случаях занимая до 30 мин и более. По окончании окрашивания препарат промывают водой, фильтровальной бумагой удаляют воду, подсушивают и микроскопируют.
Существуют простые и дифференцированные методы окраски. При простой окраске используют какой-либо один краситель, например метиленовый синий, фуксин, генциан фиолетовый в щелочных или карболовых растворах. При этом прокрашивается вся клетка. При дифференцированной окраске отдельные структуры клетки окрашиваются разными красителями. Таковы методы окраски по Граму, окраски спор. Для окрашивания микроорганизмов применяют кислые и основные красители. Первые вступают в реакцию с веществами основной природы, вторые — кислотной природы. Поскольку в белках есть и основные (NH -2) и кислотные (СООН-) радикалы, клеточные структуры хорошо окрашиваются и теми и другими красителями.
Из основных красителей наиболее часто в микробиологии применяют: красные — нейтральный красный, сафранин, фуксин, гематоксилин; синие — виктория, метиленовый синий; фиолетовые — генциан фиолетовый, кристаллический фиолетовый, метиленовый фиолетовый; зеленые — янус зеленый, метиленовый зеленый, малахитовый зеленый; коричневые — везувин, хризоидин; черные — индулин. Кислые красители могут быть следующие: красные и розовые — кислый фуксин, эритрозин; черные — нигрозин; желтые — конго, пикриновая кислота, флуоресцин. Основные красители интенсивнее окрашивают объект в более щелочной среде, кислые — в более кислой. Чтобы paзличить растворы кислых или основных красителей, в них погружают полоски фильтровальной бумаги. Они несут отрицательный электрический заряд. В случае основного окрашивающего раствора его катионы, обуславливающие окрашивающую способность, фиксируются отрицательным зарядом бумаги и по ней, вследствие капиллярности, будет распространяться только вода (в виде бесцветной полосы). Если раствор содержит кислый краситель, его анионы будут подниматься по бумаге и окрасят ее.
Красители можно разделить на позитивные и негативные. Позитивные красители окрашивают непосредственно клетки микроорганизмов и другие объекты. Из красителей, применяемых в микробиологии, большинство относится к позитивным. Они окрашивают клетки при комнатной температуре в течение 30—60с. Негативные красители окрашивают пространство, окружающее клетки микроорганизмов. В результате клетки выглядят силуэтами на окрашенном фоне.
Окраска клеток микроорганизмов по Грамму. Этот метод дифференциации микробных клеток основан на различии в химическом составе клеточных оболочек. Сущность его в том, что в клетках одних видов микроорганизмов образуется нерастворимое в спирте соединение иода с основным красителем, а у других видов это соединение появляется временно и после обработки спиртом растворяется. Микроорганизмов первой группы называют грамположителъными, второй — грамотрицательными.
Техника окраски па Граму. На хорошо обезжиренное предметное стекло наносят тонкий мазок культуры микроорганизма. Мазок высушивают на воздухе, фиксируют над пламенем горелки и окрашивают в течение 1 мин феноловым раствором генциана фиолетового (или кристаллического фиолетового), держа стекло в слегка наклонном положении. Затем краситель сливают и, не промывая препарат водой, наносят на него на 1 мин раствор Люголя (до полного почернения мазка). Стекло и в этом случае лучше держать в наклонном положении. Препарат, не промывая водой, обрабатывают, непрерывно покачивая, 96%-ным спиртом в течение 15—20 с. Очень важно четко придерживаться времени обесцвечивания, так как при превышении указанного срока обесцвечиваются и грамположительные клетки. Промыв водой, препарат окрашивают фуксином Пфейфера в течение 1 мин. После этой обработки грамположительные микроорганизмы приобретают темно-фиолетовый цвет, а грамотрицательные окрашиваются лишь в цвет дополнительной окраски (фуксина). Результаты окраски по Граму зависят от возраста культуры: в старых культурах мертвые клетки всегда окрашиваются грамотрицательно. Поэтому лучше использовать молодые односуточные культуры. Некоторые бактерии (протей) окрашиваются грамвариабелъно, т.е. часть клеток — как грамположительные, а часть — как грамотрицательные.
Красители и реактивы для окраски по Граму. 1. Феноловый раствор генциана фиолетового: генциан фиолетовый — 1 г, спирт 96%-ный — 10 мл, фенол кристаллический — 2 г, вода дистиллированная — 100 мл.
В некоторых случаях применяют спиртовой раствор генциана фиолетового: генциан фиолетовый (или кристаллический фиолетовый) — 1 г, спирт 96%-ный (ректификат) — 100 мл, глицерин — 5 мл. Бутыль со смесью ставят в термостат на 24 ч (можно и дольше), затем фильтруют.
2. Раствор Люголя (иодит калия — 2 г, иод кристаллический — 1 г, вода дистиллироианная — 300 мл). Вначале готовят концентрированный раствор нодита калия к 5 мл воды, в нем растворяют иод, потом добавляют воду до 300 мл.
3. Спирт 96%-ный.
4. Фуксин Пфейфера (водный раствор карболового фуксина Циля): 1 мл карболового фуксина Циля (см. 3.2.2) и 9 мл дистиллированной воды.
Контрольные вопросы:
1. Какие вы знаете методы приготовления препаратов?
2. Что такое фиксация препаратов?
3. С какой целью проводят окрашивание микроорганизмов?
4. Какие вы знаете красители, применяемые в микробиологии?
5. Окраска бактерий по Граму.
6. В чем различия грамположительных от грамотрицательных бактерий?
Тема: Методы культивирования микроорганизмов. Питательные среды.
Цель работы: Ознакомить студентов с методами культивирования аэробов и анаэробов, а также с видами питательных сред (простые, элективные, дифференциально – диагностические, естественные и искусственные).
Выращивание микроорганизмов на питательных средах называют культивированием (от лат, cultus — выращивание), а развившиеся в результате микроорганизмы — культурой. При развитии в жидкой среде культуры образуют суспензию, осадок или пленку, при развитии на плотной среде — колонии. Культура может быть чистой — содержать потомство клетки только одного рида и накопительной — состоять преимущественно из клеток одного вида микроорганизмов. Внесение клеток микроорганизмов или какого-либо исследуемого материала (образца почвы, пробы воды) в стерильную питательную среду для получения чистой или накопительной культуры называют посевом. Перенесение уже выращенных клеток из одной среды в другую (стерильную) называют пересевом, или пассированием (от лат. passus — чередование).
Обычно микроорганизмы выращивают при определенной постоянной температуре в термостатах (деревянных или металлических шкафах) или термостатных комнатах. В тех и других постоянная температура поддерживается с помощью терморегуляторов. Культивирование при определенной температуре называется инкубацией, или инкубированием (от лат. incubatio — выращивание, высиживание птенцов). Выращивают микроорганизмы в стеклянной посуде: пробирках, колбах или чашках Петри. Для этого стеклянную посуду, не бывшую в употреблении, очищают от щелочи кипячением и растворе, содержащем К2Сг207 (6%) и концентрированную H2SO4 (6%).
В пробирках микроорганизмы культивируют как в жидких, так и на плотных средах. Жидкой средой для аэробных культур заполняют обычно 1/3 пробирки, для анаэробных — 2/3. Если плотная среда в пробирках предназначена для последующего выращивания микроорганизмов, при подготовке к стерилизации ее наливают на 1/3 —1/4 объема пробирок.
После стерилизации пробирки с еще не застывшей средой раскладывают на ровной поверхности стола в наклонном (под небольшим углом) положении для получения скошенной поверхности агара. Это так называемые косяки — косые или скошенные среды. Плотная среда, застывшая при вертикальном положении пробирки, называется столбиком. Столбики питательной среды, занимающей 1/3 - 1/2 объема пробирки, используют для посева культуры уколом. Столбики питательной среды, занимающие 2/3 объема пробирки, после стерилизации применяют для заливки стерильных чашек Петри, предназначенных для микробиологических посевов. Пробирки со средами и культурами во время работы устанавливают в штативы; пробирки со средами, подготовленными к стерилизации, помещают в проволочные корзины или металлические ведра с отверстиями; пробирки с культурами при инкубации или хранении — в картонные коробки. При культивировании микроорганизмов в колбах используют только жидкие питательные среды. Для аэробных микроорганизмов среду наливают тонким слоем (например, 30 мл в колбы Эрленмейера на 100 мл), для анаэробных микроорганизмов колбу заполняют на 2/3 объема. В чашках Петри микроорганизмы культивируют лишь на плотных средах. Высота этой посуды — около 1,5 см, диаметр — 8—10 см, причем диаметр верхней чашки (она служит крышкой) несколько больше диаметра нижней. Для работы с микроорганизмами используют специальные бактериологические иглы, петли и шпатели. Их изготовляют из платиновой проволоки, которую закрепляют в специальных металлических держателях или впаивают в стеклянные палочки. При посевах и пересевах культур микроорганизмов из колоний, выросших на плотных средах, применяют иглы или шпатели. Суспензии микроорганизмов берут петлей.
Техника посева. Посев (или пересев) всегда проводят вблизи горелки. При посеве клеток микроорганизмов из пробирки в пробирку обе пробирки (одну — с культурой, другую — со стерильной питательной средой) берут в левую руку. Одну пробирку зажимают между указательным и средним пальцами (первая пробирка). Нижний конец ее свободно лежит на большом пальце (с его левой стороны). Вторую пробирку зажимают между средним и безымянным пальцами. Она должна лежать параллельно первой. При взятии мазка пробирки должны находиться в наклонном положении, гарантирующем стерильность культуры. При вертикальном расположении пробирок возможно попадание из воздуха посторонних клеток микроорганизмов.
В пламени горелки тщательно обжигают бактериологическую иглу (петлю), держа ее в правой руке в отвесном положении. Мизинцем правой руки вынимают из второй пробирки ватную пробку и зажимают ее между мизинцем и ладонью. Пробку первой пробирки зажимают между безымянным и средним пальцами правой руки. Снова слегка обжигают иглу и вводят ее в пробирку с культурой. Платиновая игла остывает очень быстро. Легким прикосновением ее к колонии микроорганизмов берут небольшое количество микробной массы и переносят во вторую пробирку. При высеве в плотную скошенную среду иглой с культурой легким движением, не повреждая среды, проводят прямую или волнообразную черту по ее поверхности — посев штрихом. При посеве в столбик питательной среды иглу вводят к толщу ее центральной части — посев уколом. При посеве в жидкую среду (или из жидкой среды) лишь слегка наклоняют пробирки, чтобы избежать смачивания пробок и краев пробирок. Пробки, перед тем как ими закрыть пробирки, обжигают в пламени. Удобнее сначала закрыть первую пробирку, а затем — вторую.
Хранение микроорганизмов. При длительном хранении в лабораторных условиях могут измениться отдельные физиолого-биохимические или морфологические особенности микроорганизмов. Чтобы избежать этого, необходимо хранить культуру чистой и в жизнеспособном состоянии. Традиционный метод хранения — пассирование (субкультивирование), т. е. пересев на свежие питательные среды с временными интервалами в зависимости от вида микроорганизма, среды и условий хранения. Одни виды микроорганизмов требуют частых пересевов, другие можно не пересевать более месяца. В процессе такого хранения нельзя допускать пересыхания среды. Для этого пробирки с культурами рекомендуют обертывать бумагой или пленкой и хранить в условиях, когда процессы жизнедеятельности заторможены, например, в холодильнике при 5—8 °С. Существует ряд других способов хранения культур: под слоем стерильного вазелинового масла; в ампулах с жидким азотом; в лиофилизированном состоянии, т. е. высушенными из замороженною состояния. Спорообразующие бактерии могут храниться годами в стерильной сухой почве или соответствующей среде.
Питательные среды. С. Я. Виноградским в практику микробиологии были введены элективные, или избирательные, среды, предназначенные для определенных групп микроорганизмов. Они составлены в расчете на предельно строгие условия, при которых должен развиваться только избранный микроорганизм и никакой другой. Основной принцип элективных сред— учет избирательных потребностей микроорганизма в специфических условиях развития. Примером элективных сред могут служить среды для выделения азотфиксаторов, иитрификаторов. Эти среды применяют главным образом для выделения микроорганизмов из мест их природного обитания и получения их накопительных культур.
Накопительные среды были предложены голландским ученым М. Бейеринком. В них интересующий исследователя компонент среды дается в избытке, чтобы выяснить, какой микроорганизм или группа микроорганизмов его использует, поскольку именно он или они будут доминировать в этой среде.
Оптимальные среды предложил А. А. Имшенецкий для целлюлозоразрушающих микроорганизмов, В. С. Буткевич - для продуцента лимонной кислоты Aspergillus niger. Основной принцип оптимальных сред заключается в создании наиболее благоприятных условий для избранных микроорганизмов внесением в среду различных стимулирующих рост добавок (витаминов, ростовых веществ, микроэлементов).
По составу среды подразделяются на две группы: естественные (натуральные) и синтетические. Естественными обычно называют среды, которые состоят из продуктов животного или растительного происхождения, имеющих сложный неопределенный химический состав. Это — различные части растений, животные ткани, солод, дрожжи, навоз, почва, вода морей, озер и минеральных источников. Их используют чаще в виде экстрактов или настоев. Hа естественных средах хорошо развиваются многие микроорганизмы, так как в них есть все компоненты, необходимые для роста. Естественные среды используют главным образом для поддержания культур микроорганизмов, накопления их биомассы и диагностических целей.
Синтетические — это такие среды, в состав которых входят в точно указанных концентрациях, только известные химически чистые соединения. Синтетические среды бывают простыми и достаточно сложными по составу. Их широко используют для исследований, связанных с изучением обмена веществ микроорганизмов. Существуют и так называемые полусинтетические среды, относящиеся к средам с неопределенным составом. В них наряду с соединениями известной химической природы входят вещества неопределенного состава. Например, в мясной бульон наряду со сложными и неопределенными по химическому составу веществами (мясной бульон) могут входить пептон, глюкоза или сахароза, поваренная соль, фосфат калия; картофельные среды содержат глюкозу и пептон. Полусинтетические среды широко используют в микробиологической практике для получения витаминов, антибиотиков, аминокислот и других продуктов жизнедеятельности микроорганизмов.
Питательные среды могут быть различной консистенции: жидкие, плотные, полужидкие. Плотные питательные среды используют для учета количества бактерии, выделения чистой культуры и других целей. Такие среды готовят из жидких, добавляя 1,5—2,5% агара или 10-15% желатины. При приготовлении полужидких сред вносят 0,1-0,2% агара. Агар — это растительный коллоид, получаемый из некоторыx морских водорослей. В его состав входят главным образом полисахариды, а также ничтожное количество азотистых веществ. Выпускают агар в виде пластин, стебельков, порошка. Большинство микроорганизмов не используют его в качестве субстрата, и поэтому агар удобен как инертный уплотнитель среды. Температура плавления агара — 100 °С, затвердения — 40 °С.
Желатина — кислый азотсодержащий продукт, добываемый при выварке костей, хрящей, сухожилий, чешуи рыб. Температура плавления желатины (22—25°С) ниже температуры инкубации большинства микроорганизмов (30—37°С). Эта особенность и способность многих микроорганизмов разжижать желатину, выделяя протеолитические ферменты, ограничивают ее применение в качестве уплотняющего средства.
Приготовление питательных сред. Мясо-пептонный бульон (МПБ). Для приготовления мясо-пептонных сред используют мясной бульон, который получают следующим образом: 500 г мелко изрубленного свежего мяса без костей, жира и сухожилий заливают в эмалированной кастрюле 1 л водопроводной воды, нагретой до 50 °С, и оставляют настаиваться 12 ч при комнатной температуре или 1ч при 50—55 °С. Мясо отжимают, экстракт процеживают через марлю со слоем ваты, кипятят 30 мин для свертывания коллоидных белков и фильтруют дважды (первый раз через марлю с ватой, второй — через бумажный фильтр). Фильтрат доливают водой до 1 л, разливают в колбы, закрывают ватными пробками и стерилизуют при 120°С 20 мин (пробки колб закрывают сверху колпачками из бумаги). Для приготовления МПБ к 1 л мясного бульона добавляют 5—10 г пептона (первый продукт гидролиза белка) для повышения калорийности среды и 5 г поваренной соли для создания осмотической активности. Среду нагревают до растворения пептона, постоянно помешивая.Затем устанавливают нейтральную или слабощелочную реакцию среды, приливая 20%-ный раствор Na2CO3 до посинения влажной красной лакмусовой бумажки. После установления рН среду снова кипятят 5—10 мин, и белки, свернувшиеся при изменении реакции среды, отфильтровывают через бумажный фильтр без осветления бульона или осветлив его белком. Для этого свежий яичный белок вбивают с двойным по объему количеством воды и смешивают с охлажденным до 50°С бульоном. Смесь кипятят, помешивая, на слабом огне 10 мин, затем фильтруют. Прозрачный мясо- пептонный бульон разливают в пробирки, закрывают ватными пробками и стерилизуют при 120°С 20 мин.
Мясо-пептонный агар (МПА). К 1 л МПБ добавляют 15— 20г агара. Среду нагревают до растворения агара (температура его плавления - 100 °С, затвердевания— 40 °С), устанавливают слабощелочную реакцию среды 20%-ным раствором Nа2,CO3 и через воронку разливают в пробирки (приблизительно по 10 мл агара сголбиком для последующего разлива по чашкам Петри и по 5 мл для получения скошенного агара — косяков). Пробирки со средой стерилизуют в автоклаве при 120 °С 20 мин.
Мясо-пептонная желатина (МПЖ). В 1 л МПБ помешают 100 — 150г желатины. Темпер
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 1737; Нарушение авторских прав?; Мы поможем в написании вашей работы!