
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Замещение гидроксильных групп спиртов
|
|
|
|
Обмен галогена на галоген
Получение галогенпроизводных из эфиров сульфокислот
Галогенирование ароматических соединений
Может протекать как в ядро, так и в боковую цепь:
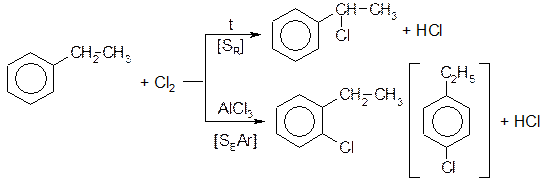
Реакция бромирования протекает по такому же типу при несколько более высоких температурах. Йодируют ароматические соединения в ядро [SEAr] с использованием специальных составов, содержащих катион йода:
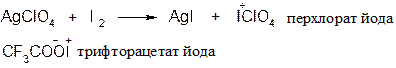
Реакции по α-углеродному атому проводят у ароматических соединений при меньших температурах, чем у алканов (α-положение более реакционноспособно).
14.1.4 Получение ароматических галогенпроизводных
из анилина и его производных
Разработал Зондмайер:


Филькештейн обнаружил, что в галогенпроизводных можно обменивать галогены, например:
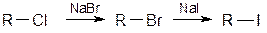
Очень легко заместить на йод хлор или бром, т.к. йодистый натрий растворим в ацетоне, а NaCl или NaBr не растворимы.
Легкость замещения галогена на галоген падает в ряду: I → Br → Cl.
При кипячении спиртов с концентрированными галогенводородными кислотами получают галогенпроизводные по обратимому процессу.
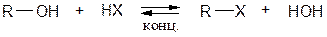
Легче идет реакция с HI, труднее с HCl.
Из спиртов наиболее реакционоспособны третичные.
В лабораторных условиях вместо концентрированных кислот используют галоген-ангидриды фосфорной или серной кислот и карбоновых кислот.
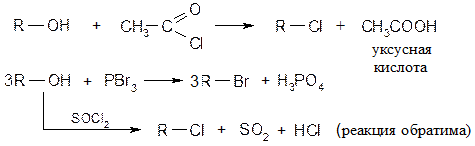
Закономерности реакций нуклеофильного замещения
у насыщенного атома водорода
| № п/п | SN1 мономолекулярный | SN2 бимолекулярный | SNi |
| 1. Механизм | 
| 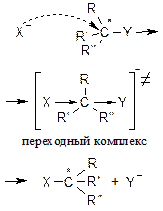
| 
|
| 2. Кинетика | 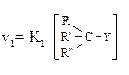 Мономолекулярное замещение (скорость реакции зависит от концентрации одного компонента - субстрата)
Мономолекулярное замещение (скорость реакции зависит от концентрации одного компонента - субстрата)
| 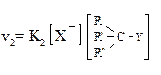 Бимолекулярное замещение (в кинетическом уравнении – концентрации и реагента и субстрата)
Бимолекулярное замещение (в кинетическом уравнении – концентрации и реагента и субстрата)
| 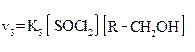 Реакция характерна только для замещения гидроксильных групп спиртов.
Реакция характерна только для замещения гидроксильных групп спиртов.
|
| 3. Стереохимия | SN1 - правило: рацемизация (или частичное обращение конфигурации) | SN2 - правило: обращение конфигурации (подход реагента с противоположной стороны по отношению к уходящей группе) | SNi - правило: полное сохранение конфигурации (атака со стороны уходящей группы) |
| 4. Влияние растворителя | Реакция облегчается полярными растворителями, как нуклеофильного (вода, спирты), так и электрофильного характера: бензол с акцепторными группами
| Умеренное влияние растворителя; реакции способствуют растворители, связывающие электрофильную часть молекулы (облегчают подход и уход заряженной частицы - апротонные, нуклеофильные растворители). Например, простые эфиры, нитрилы, амины. | Растворители не влияют на скорость и стереохимию процесса. |
| 5. Влияние эффектов заместителей | Относительно слабое влияние пространственных эффектов, но сильное влияние эффектов сопряжения C2H5 v=1 CH3-Br v=0,8 (CH3)2CH-Br v=11,6 (CH3)3C-Br v=1,2·106 | Преобладающее влияние пространственных эффектов C2H5 v=1 CH3-Br v=145 (CH3)2CH-Br v=0,078 (CH3)3CH-Br v=0,00051 | Слабое влияние пространственных эффектов, значительное влияние полярных эффектов |
| Относительная скорость реакции | При прочих равных условиях скорости реакций нуклеофильного замещения, как правило, уменьшаются в ряду: третичные > вторичные > первичные. | ||
| 6. Влияние характера замещающих групп | Скорость реакции тем быстрее, чем беднее энергией уходящая группа (чем стабильнее уходящая группа). Это обусловлено энергией связи C-Y в первую очередь и C-X во вторую очередь. Для галогенов самая богатая энергией группа Clˉ, самая бедная - Iˉ. | ||
| 7. Влияние характера реагентов | Предпочтительнее реакция с более электроотрицательным реагентом, имеющим значительное сродство к электрону. | Предпочтительнее реакция с более нуклеофильным реагентом (способность образовывать связи с атомом углерода - нуклеофильность). | Нет влияния |
| 8. Побочные реакции | Отщепления по механизму E1, перегруппировки углеродного скелета | Отщепления по механизму E2 | Нет |
Примечания:
Как следует из графы 8 таблицы, реакции SN и E являются конкурирующими. Например, после образования карбокатиона [SN1] возможны два пути дальнейшего процесса – образование продукта замещения (Х- нуклеофил), или продукта отщепления (Х- основание):
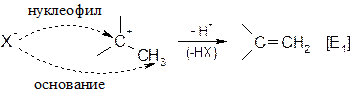
Подобная реакция возможна и по бимолекулярному механизму [SN2]:
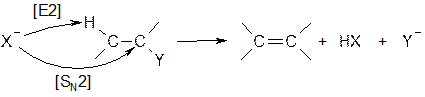
Для перегруппировки необходимо образование первичного или вторичного карбокатиона:

Практически нет реакций, которые бы протекали исключительно по одному из представленных механизмов SN1, SN2. Поэтому можно говорить лишь о преимущественном протекании реакции по тому или иному механизму. Так, первичные производные реагируют в основном по механизму SN2, третичные - по механизму SN1, вторичные - либо по SN1, либо по SN2 (в зависимости от строения молекулы).
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!