
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ci2 + KOH ® kci + kcio3 + H2O
|
|
|
|
CI2 + KOH ® KCI + KCIO + H2O.
В горячей щелочи реакция протекает глубже, хлор окисляется до состояния +5 с образованием бертолетовой соли:
T
Сера при нагревании также диспропорционирует с образованием сульфита и сульфида, сера +4(сульфит) может переходить в сульфат и сульфид:
S + KOH ® K2SO3 + K2S + H2O
K2SO3 ® K2S + K2SO4.
Рассмотрим несколько других, в т.ч. более сложных примеров межмолекулярных реакций. При смешивании сероводорода с сернистым газом образуется свободная сера. Окислитель и восстановитель – сера в различных степенях окисления:
SO2 + H2S ® S¯ + H2O.
Гидрид натрия в воде выделяет газообразный водород. Водород –1 – сильнейший окислитель, а водород воды +1 выполняет роль окислителя:
NaH + H2O ® NaOH + H2.
Азотная кислота окисляет все, что только может окислиться, например в реакции с сульфидом мышьяка сульфидная сера –2 окисляется до высшего состояния +6 (серная кислота), а мышьяк +3 переходит в +5 (мышьяковая кислота), сама азотная кислота при этом восстанавливается до оксида азота. Всего в реакции отдается 28 электронов, а присоединяется только 3:
3As2S3 + 28HNO3 + 4H2O ® 6H3AsO4 + 9H2SO4 + 28NO
N+5 + 3e ® N+3 28
2As+3 - 4e ® 2As+5
3S-2 - 24e ® 3S+6 3
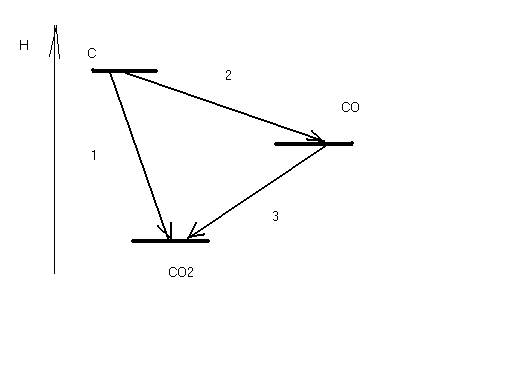
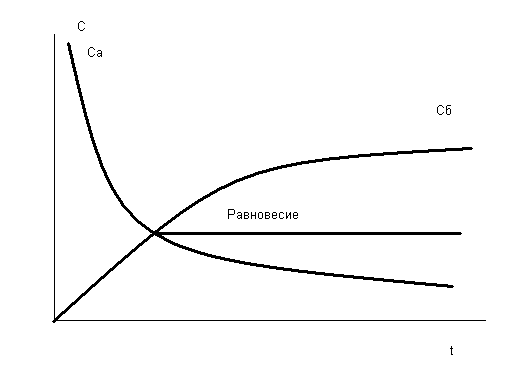
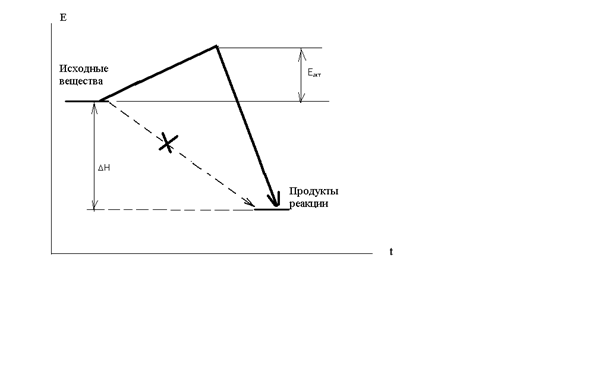
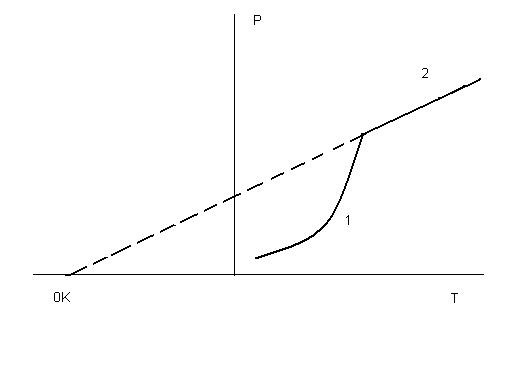
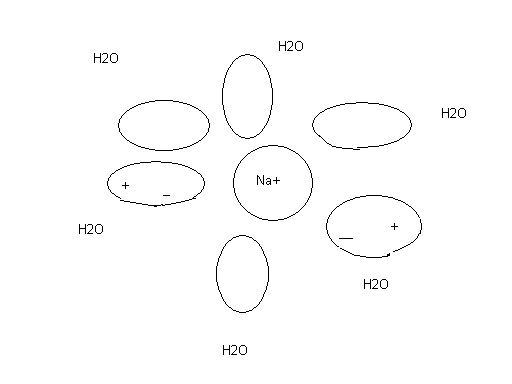
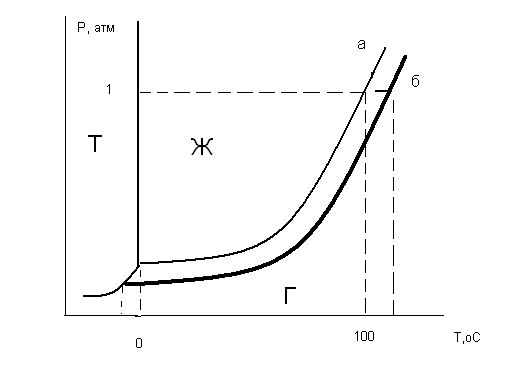
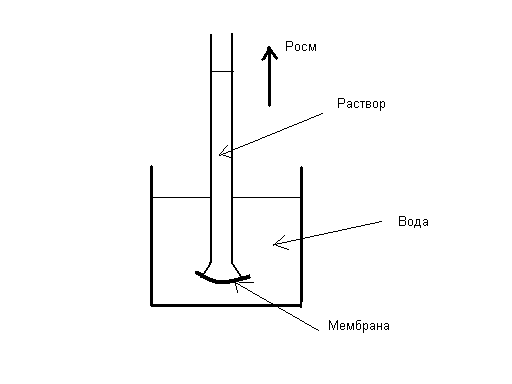
В зависимости от условий протекания реакции взаимодействия серной кислоты с металлическим алюминием (температура, концентрация кислоты, состояние поверхности металла) могут быть получены разные продукты, или даже сложные смеси в жестких неуправляемых условиях: AI + H2SO4 разб ® AI2(SO4)3 + H2 (окислитель – ион водорода), AI + H2SO4 конц ® AI2(SO4)3 + SO2 + H2O (окислитель – S+6), Т AI + H2SO4 конц ® AI2(SO4)3 + SO2 + H2S + S¯ + H2O Если взять для реакции с крепкой кипящей кислотой алюминиевую пудру с громадной удельной поверхностью (десятки квадратных метров в одном грамме), скорость реакции на такой поверхности многократно возрастет и неминуемо прогремит мощный взрыв: AI (пудра) + H2SO4 конц., кипящая ® ничего хорошего! Многие химические реакции как раз относятся к разряду сложных окислительно-восстановительных процессов. Для предсказания направления таких реакций, ожидаемых продуктов и т.п. требуется проведение специальных исследований. Лекция 3. Необходимое условие реакции Рассмотрим теперь общие закономерности реакции. Под химической системой понимают тело или группу тел, мысленно изолированных от окружающей среды. Однородная система называется гомогенной, система, содержащая поверхности, отделяющие части с различными свойствами, называется гетерогенной. Совокупность гомогенных частей системы называется фазой. Обозначение фаз веществ в реакции: [ ] – твердая фаза; { } – жидкая фаза; () – газовая фаза. Важнейший признак химической реакции – тепловые изменения. DQ>0 означает выделение тепла, экзотермическую реакцию, DQ<0 – поглощение тепла, эндотермическую реакцию. Наблюдатель – в окружающей среде, которая получает тепло, поэтому «+». В химии принято рассматривать процесс с точки зрения системы. Процесс при постоянном объеме системы называется изохорным, а при постоянном давлении – изобарным. Тепловой эффект химической реакции в изобарных условиях c противоположным знаком называется изменением энтальпии: -(DQ) р=const = DH Н = U + PV DH = DU + PDV, U – внутренняя энергия системы, P,V – давление и объем Закон Лавуазье-Лапласа. Тепловой эффект прямой реакции равен с противоположным знаком эффекту обратной реакции. Закон Н.Гесса (1840г.) Тепловой эффект зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса. DU = U2 - U1 Рис.3.1 Функция состояния системы Внутренняя энергия – функция состояния системы, не зависит от пути перехода из состояния 1 в состояние 2. Гесс доказал, что и тепловой эффект реакции обладает тем же свойством. Например, рассмотрим процесс горения углерода. С + О2 = СО2 DH1 = - 393,5 кДж/моль 1.С + 1/2О2 = СО DH2 2.СО + 1/2О2 = СО2 DH3 DH1 =DH2 + DH3 Рис.3.2 Иллюстрация закона Гесса Свойство независимости теплового эффекта от пути процесса может быть использовано для определения DH любой реакции расчетным путем, например, вычислим тепловой эффект горения метана: (СН4) + 2(О2) = (СО2) + 2(Н2О) DH =? Все сложные вещества составлены из простых. Разрушим исходное сложное вещество (метан) на составные части, а затем образуем из простых тел требуемые продукты реакции (углекислый газ и вода). Представим себе следующие мысленные промежуточные стадии реакции: 1. СН4 = С + 2Н2 + 74,85 кДж/моль (см. таблицу 3.1) 2. С + О2 = СО2 - 393,5 кДж/моль 3. 2Н2 + О2 = 2Н2О(г) - 2 ·241,8 кДж/моль Искомый тепловой эффект равен сумме эффектов промежуточных стадий: DH = (+ 74,85 - 393,5 - 2 ·241,8) кДж. Тепловой эффект реакции образования одного моля сложного вещества из простых тел называется стандартной энтальпией образования. Это табличные данные, важнейшая характеристика любого сложного вещества. DHо обр (простого вещества) º0 DHоСО2 = - 393,5 кДж/моль и так далее. Как правило, при образовании сложного вещества из простых тел тепло выделяется, эндотермические соединения неустойчивы (табл.3.1). Таблица 3.1 Термодинамические характеристики некоторых веществ при стандартных условиях (Т=298К, Р= 760 мм рт.ст) Для любой реакции n1 А1 + n2 А2 + ni Аi = n1 B1 + n2 B2 + nj Bj i ¹ j следствие из закона Гесса может быть представлено в виде: DH = S nj DHоBj - S ni DHоАi. j i Границы применимости закона Гесса могут быть получены при обсуждении постулатов (начал) термодинамики, запрещающих так называемые «вечные» двигатели. Первое начало представляет собой закон сохранения энергии для процессов с участием тепловой формы энергии. Изменение внутренней энергии системы DU может быть выражено тепловым эффектом, механической и всеми другими видами работы: DU = DQ - А мех + S Аi. А мех = PDV, и при отсутствии всех видов работы кроме механической получаем: DU = DQ - PDV. а) V=const DU = DQ, то есть тепловой эффект представляет собой изменение внутренней энергии системы, является тем самым функцией состояния системы. б) Р=const DQ = DU + PDV = D(U + PV) = DH, в изобарных условиях тепловой эффект есть изменение энтальпии, тоже функции состояния. При добавлении других видов работы, например, электрической, приведенные рассуждения несправедливы и тепловой эффект будет сильно зависеть от пути реакции. Окислительно-восстановительный процесс может быть реализован химически или электрохимически в топливном элементе, тепловой эффект при этом не только способен изменить значение, но и даже знак. Вопрос о направленности реакции решается в рамках второго постулата термодинамики, согласно которому запрещено полное, без потерь превращение тепла в работу. Перенос тепла возможен только от горячего к холодному, не наоборот: DH = DG + (DH)¢, где DG – полезное тепло, изменение энергии Гиббса, а второй член – неизбежные потери тепла. Показано, что это «бесполезное» тепло связано с изменением функции состояния системы, называемой энтропией. (DH)¢ = Т DS Энтропия (S) – мера неупорядоченности (беспорядка) системы. DG = DH - Т DS. Понятие «беспорядок» строго определяется в статистической термодинамике и связывается с числом способов осуществления данного состояния (W). Это число способов осуществления называют термодинамической вероятностью: S = k lnW, где k – постоянная Больцмана. При переходе от кристалла к жидкости и пару беспорядок системы растет, особенно в газовой фазе, где молекулы двигаются хаотично, беспорядочно. Энтропия одного моля газа примерно составляет 200-250 Дж/моль·град. Знак изменения энтропии в химической реакции может быть оценен при сравнении числа газовых молей в левой и правой частях уравнения. Расчет изменения энтропии аналогичен расчету изменения энтальпии химической реакции, только следует учитывать как сложные, так и простые вещества: DS = S nj SоBj - S ni SоАi. j i Энтропия идеального кристалла при Т=0К равна нулю, такое состояние может быть осуществлено одним единственным способом, имеем «полный» порядок, это начало отсчета: S = k ln1 = 0 Увеличение энтропии всегда выгодный, самопроизвольно протекающий процесс, как и снижение энергии системы. Оба всеобщих принципа минимума энергии и роста энтропии совмещены в выражении второго начала термодинамики. Рассмотрим возможные варианты энтальпийного и энтропийного вкладов в изменение энергии Гиббса. 1. Экзотермический процесс с увеличением энтропии. DH<0, DS>0, например: KCIO3 ® KCI + 3/2 O2. Вне зависимости от температуры, при "Т DG<0, это необходимое условие необратимого процесса слева направо. 2. Эндотермический процесс с уменьшением температуры, DH>0, DS<0. Вне зависимости от температуры, при "Т DG>0, это условие запрета процесса слева направо. Не может быть таких физических условий, при которых бы хлорид калия прореагировал с кислородом с образованием бертолетовой соли. 3. DH<0, DS<0 или DH>0, DS>0. Один фактор способствует протеканию реакции, а другой препятствует. В этом случае неизбежно существует такая равновесная температура Травн, при которой DG=0. Это условие равновесия, обратимой химической реакции, которая разрешена и слева направо и наоборот – справа налево. 0= DG = DH - Травн DS, откуда значение Травн = DH/DS. Например, при какой температуре установится равновесие в гомогенной газовой системе (Н2) + ½(О2) «(Н2О)? DHоН2О (газ) = - 241,84 кДж/моль, SоН2О (газ) = 188,74 Дж/моль·K SоO2 (газ) = 205 Дж/моль·K, SоH2 (газ) = 130,6 Дж/моль·K, DHоН2 =DHоО2=0 DH=DHоН2О (газ) = - 241,84 кДж/моль. DS= SоН2О (газ) - SоH2 (газ) - 1/2 SоO2 (газ) = 188,74 - 130,6 - 102,5 = - 44,36Дж/моль·K = - 0,044 кДж/моль·K Травн = DH/DS = (- 241,84): (- 0,044) = 5500K DG = DH - Т DS При Т<5500К для прямой реакции DG<0 и этот процесс разрешен, водород горит в кислороде с образованием воды; при Т>5500К прямой процесс запрещен: DG>0, протекает обратная реакция термической диссоциации воды. При 5500К имеем состояние равновесия. Упрощенное рассмотрение, которое не учитывает температурные зависимости DH и DS и динамический характер равновесия во всем интервале температур, а не только в крайних случаях смещения равновесия влево и вправо. Особенности этого состояния будут подробно рассмотрены на следующей лекции. Лекция 4. Химическая кинетика и равновесие Термодинамическое разрешающее условие DG<0 является необходимым, но не достаточным. Должны быть созданы условия для протекания процесса с заметной скоростью. uср = DС/Dt Скорость реакции – изменение концентрации за единицу времени. В дифференциальной форме: u = ± dC/dt скорость есть первая производная концентрации по времени. Для реакции А ® В DСА = С2 – С1 < 0, поэтому производная, берется со знаком «минус», иначе получится отрицательная скорость. При использовании концентраций продуктов реакции (В) производная со знаком «плюс». Изменение концентраций веществ А и В графически можно представить следующим образом: Рис.4.1 Скорости прямой и обратной реакций во времени Скорость реакции зависит от ряда факторов, прежде всего от концентраций реагирующих веществ. Пусть в газовой фазе протекает реакция между веществами А и В с образованием продукта АВ. В любой фиксированной точке пространства молекулы А могут оказаться с какой-то вероятностью Р(А). В этой же точке могут оказаться молекулы В с вероятностью Р(В). Химическая реакция возможна между А и В только при соударении молекул, пусть вероятность этого события будет Р(АВ). Соударение – событие совместное, вероятность равна произведению вероятностей (при несовместном событии – суммация): Р(АВ) = Р(А) · Р(В). Левая часть уравнения пропорциональна скорости реакции, а вероятности Р(А) и Р(В) прямо пропорциональны концентрациям веществ А и В, для перехода от пропорциональности к равенству введем коэффициент пропорциональности к – константу скорости: u = к СА · СВ Физический смысл к: к=u при СА = СВ = 1 моль/л. Если в реакции принимают участие m молей А n молей В, выражение для скорости реакции принимает вид: u = к САm · СВn. Сумму показателей степеней называют порядком реакции. Полученное уравнение является одним из основных в кинетике реакций, это закон действия масс. Вероятность соударения трех и более молекул минимальна и быстро падает до нуля, поэтому любая химическая реакция протекает не сразу, а в несколько стадий. На каждой стадии сталкиваются две, максимум три молекулы. Число молекул, соударением между которыми определяется акт химического превращения, называется молекулярностью реакции. Совокупность стадий химической реакции называется ее механизмом. Самая медленная стадия называется лимитирующей (контролирующей, определяющей). Скорость реакции в целом определяется скоростью лимитирующей стадии. Решающее влияние на скорость реакции оказывает изменение температуры. Температурная зависимость скорости реакции выражается правилом Вант - Гоффа: при увеличении температуры на 10о скорость реакции возрастает в 2-4 раза. При охлаждении происходит снижение скорости в такое же число раз: u Т+DТ / uТ = g DТ/10 где g - температурный коэффициент реакции равный 2-4. В чем заключается причина такого сильного влияния температуры на скорость реакции? Ведь при увеличении на 100о при g=3 скорость увеличится в 310 раз! Общее число соударений между молекулами в газовой фазе при этом возрастает всего в 1,2 раза, это доказано в молекулярно-кинетической теории газов. Дело заключается в том, что исходные вещества, если они существуют сами по себе, то есть стабильны, не могут превратиться в продукты реакции без начальных затрат энергии, необходимо преодолеть энергию межэлектронного отталкивания при соударении молекул. Этот энергетический барьер на пути реакции называется энергией активации – это минимальная энергия, которую необходимо затратить, чтобы началась химическая реакция. Рис.4.2 Энергия активации реакции DН – изменение энтальпии, рассмотрен случай экзотермической реакции, Еакт – энергия активации. Кинетическая энергия сталкивающихся молекул может быть меньше величины энергии активации и тогда реакция невозможна, соударении неэффективно. Переход в продукты реакции возможен только в противоположном случае, когда энергия соударения превышает активационный барьер (эффективное соударение). С ростом температуры растет скорость движения молекул, их кинетическая энергия – еще в большей степени (mu2/2), поэтому сильно возрастает доля эффективных соударений в общем числе и, соответственно, скорость реакции. Нагреванием можно «разогнать» реакцию даже вплоть до взрыва, а при снижении температуры реакцию можно остановить, «заморозить». В случае гетерогенной системы реакция протекает на поверхности твердой фазы и ее скорость будет существенно зависеть от величины поверхности. Например, скорость выделения водорода из кислоты на металлическом порошке гораздо больше, чем на отдельной грануле. Скорость химической реакции можно существенно увеличить добавлением в систему катализатора. В случае гомогенного катализа (участники реакции и катализатор в одной фазе) изменяется механизм процесса в сторону снижения энергии активации, например, реакция окисления сернистого газа кислородом: SO2 + O2 = SO3 Еакт катализируется диоксидом азота. Механизм катализа двухстадийный: 1. SO2 + NO2 = SO3 + NO Еакт̉’ 2. NO + O2 = NO2 Еакт” при этом Еакт’ << Еакт и Еакт” << Еакт. При гетерогенном катализе реакция будет протекать на поверхности катализатора. При этом за счет адсорбции увеличена концентрация исходных веществ, химические связи в которых ослаблены за счет образования промежуточных соединений. До сих пор в химии не создана общая теория гетерогенного катализа, процессы слишком сложны. В ряде случаев на скорость реакции может оказать влияние так называемый стерический, пространственный фактор. Например, в реакции гидрирования ненасыщенных углеводородов важно, чтобы столкновение алкена с молекулой водорода произошло определенным образом, молекула водорода должна попасть именно в двойную связь, к которой и происходит ее присоединение. Стерические затруднения могут существенно тормозить процесс. Таковы основные кинетические закономерности химической реакции. Во многих случаях система обратима, когда имеем одинаковые знаки изменения энтальпии и энтропии. Рассмотрим подробнее свойства состояния химического равновесия. Во-первых, химическое равновесие устойчиво, то есть система будет пребывать в состоянии равновесия сколь угодно длительное время при поддержании постоянных внешних условий. Во-вторых, химическое равновесие подвижно. Если изменить одно из условий, при которых система находится в равновесии, например, температуру, давление или концентрацию, то равновесие сместится в направлении реакции, которая противодействует этому изменению (при прочих равных условиях) – это принцип Ле-Шателье. (PCI5) «(PCI3) + (CI2) DH>0, DS>0. При увеличении температуры это равновесие смещается вправо, в сторону реакции с поглощением тепла. При увеличении давления равновесие смещается влево, в сторону реакции с уменьшением давления. При уменьшении концентрации хлора равновесие смещается вправо, в сторону реакции с увеличением этой концентрации. Так обратимый процесс можно довести практически до конца. Реакция системы направлена на компенсацию возмущающего действия, в сторону возврата в состояние равновесия. В живом организме одновременно протекает много процессов, это более сложная система и в этом случае говорят не о равновесии, а о гомеостазе – способности живого организма к саморегуляции при изменении условий окружающей среды. И, в третьих, химическое равновесие имеет динамический характер. Химические реакции не остановлены, и прямой, и обратный процессы продолжают протекать, но без видимых изменений. Пусть uпр – скорость прямой реакции, а uобр – скорость обратной реакции в обратимой системе mA + nB «pC qD. uпр = Kпр СAm CBn, а uобр = Kобр ССp CDq. Кривые uпр и uобр (Са и Сб на рис.4.1 для реакции А → В) расположены таким образом, что в какой-то момент времени пересекаются и далее состоянию равновесия соответствует линия, параллельная оси времени, при этом выполняется кинетическое условие равновесия – равенство скоростей прямой и обратной реакций: uпр = uобр Kпр СAm CBn = Kобр ССp CDq. Приводим равенство к виду: ССp CDq / СAm CBn = Kпр / Kобр. Отношение констант скоростей реакций не зависит от концентраций, это также константа при данной температуре, обозначим ее Кс – константой химического равновесия. В случае газообразных веществ удобнее пользоваться не концентрациями, а парциальными давлениями компонентов системы. ССp CDq / СAm CBn = Кс; РСp РDq / РAm РBn = Кр. Константа равновесия – постоянная при данной температуре величина, которая определяет соотношение концентраций (парциальных давлений) всех веществ – участников равновесия. Изменим (увеличим концентрацию вещества С), тогда все концентрации изменят значения таким образом, чтобы константа равновесия сохранила свое постоянное значение. Вещество С в знаменателе, значит, возрастут концентрации веществ А и В в числителе, равновесие смещается влево в сторону обратной реакции (по принципу Ле-Шателье). Например, для гомогенной газовой системы: 2(Н2) + (О2) «2(Н2О) выражение для константы равновесия Кр может быть записано в виде: Кр = Р2Н2О /P2H2• PO2, а для гетерогенной реакции: [CaCO3] «[CaO] + (CO2) Кр = PCO2, потому что твердые вещества оксид и карбонат кальция являются фазами постоянного состава, их концентрации не изменяются и как постоянные величины автоматически включаются в константу равновесия. Фазовые равновесия имеют названия, если речь идет о превращении твердого вещества X в жидкость, то это плавление: [X] «{X}. [X] «(X) – это равновесие сублимации, {X}«(X) – а это равновесие испарения. В химической термодинамике показано, что константа химического равновесия прямо связана со стандартным изменением энергии Гиббса: ΔGo = – RTlnK = ΔHo – TΔSo, где R – газовая постоянная. Например, для равновесия сублимации Кр = Рx, – RTln Рx = ΔHo – TΔSo. Решаем относительно Рx: Рx = exp(ΔSo/R – ΔHo/ RT) На рис.4.3 представлен график температурной зависимости давления от температуры. Рис.4.3 Давление пара вещества 1 – область насыщенного пара; 2 – область ненасыщенного пара Давление пара вещества развивается по экспоненте – это область насыщенного пара (1), когда пар находится в равновесии с твердой фазой. После перехода в пар всего вещества наступает область гомогенного газового равновесия, то есть область ненасыщенного пара (2). Здесь давление развивается по прямой термического расширения идеального газа в соответствии с уравнением состояния идеального газа Менделеева-Клапейрона: PV = mRT/M, где m – масса газа, М – молекулярная масса. Газовая постоянная R= 0,082 л•атм/ моль•К = 62400 мл• мм Hg/ моль•К. Представления о газовом состоянии окажутся полезными далее в теории растворов. Растворы, прежде всего водные системы, представляют для нас особый интерес. Лекция 5. Основы теории растворов Растворами называются термодинамически устойчивые гомогенные системы переменного состава, состоящие из двух или более компонентов. Компонентами растворов являются растворитель (компонент 1) и растворенное вещество или вещества в любом количестве (компонент 2). Деление на растворитель и вещество относительно, обычно растворителем называют тот компонент, которого больше. Если раствор изолировать от окружающей среды, он и будет находиться в этом состоянии сколь угодно долгое время, система устойчива. Соотношение растворитель – вещество может изменяться в широких пределах, а раствор остается тем же раствором, речь идет о системе переменного состава. Находящиеся в растворе частицы растворенного вещества имеют разный размер. В зависимости от размера растворенных частиц растворы делятся на истинные растворы и дисперсные гетерогенные системы. В истинных растворах растворенные вещества в виде отдельных молекул или ионов равномерно распределены по всему объему системы среди таких же частиц растворителя. Размеры обычных молекул и ионов не превышают 1 нм (10-9 м), поэтому истинные растворы – системы гомогенные, т.е. однородные на молекулярном уровне. Межфазная поверхность в них отсутствует. Дисперсные гетерогенные системы имеют сильно развитую межфазную поверхность, т.к. растворенные частицы гораздо крупнее молекул. Такие системы состоят из сплошной непрерывной фазы растворителя – дисперсионной среды и находящихся в этой среде раздробленных частиц растворенного вещества – дисперсной фазы. В коллоидных растворах растворенные частицы могут иметь размеры в интервале 1-100нм. Системы, включающие раздробленные частицы с диаметром более 100нм, относятся к тонко и грубодисперсным гетерогенным системам. Обязательным условием получения дисперсных систем является взаимная нерастворимость дисперсионной среды и дисперсной фазы. Дисперсные гетерогенные системы термодинамически неустойчивы, т.к. в них самопроизвольно происходят процессы, приводящие к укрупнению частиц растворенного вещества. Поэтому с течением времени такие системы разделяются на исходные компоненты (расслаиваются, рассеиваются, высыхают). В группу истинных растворов попадают многие газовые, жидкие и твердые системы. Примером газового раствора является обычный воздух – смесь газов O2, N2, CO2 и др., если бы в нем не было пыли и жидкой воды Жидкие растворы получаются при растворении в жидком растворителе, например воде, газов (CO2), жидких веществ (C2H5OH) или твердых веществ (NaCl). Примерами твердых растворов являются раствор газообразного водорода в твердом палладии, амальгамы (раствор жидкой ртути в твердых металлах), сплавы. Наиболее распространены жидкие растворы, в которых растворителям является вода. Далее речь пойдет только о водных растворах. Например, растворяем в воде чайную ложку сахара. Добавим еще одну ложку, перемешаем и т.д. Начиная с некоторой концентрации, сахар перестал растворяться и его избыток находится на дне стакана. Раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. До момента достижения такой концентрации раствор был ненасыщенным, гомогенным. Концентрация насыщенного раствора называется растворимостью вещества и обычно выражается в граммах этого вещества в расчете на 100г воды. Растворимость газов всегда понижается при нагревании. Почему? (X) «{X} H2O Переход слева направо из беспорядочного состояния газа в водный раствор сопровождается снижением энтропии DS<0, поэтому необходимо выделение тепла DН<0, в противном случае DG>0 и процесс будет запрещен. По принципу Ле-Шателье равновесие при повышении температуры смещается влево. В случае растворения в воде твердого вещества ситуация иная: [X] «{X} H2O, DS>0 и жесткого ограничения на знак теплового эффекта не будет, процесс растворения твердого тела может быть как экзотермическим, так и эндотермическим. Например, при растворении NaCI полярные молекулы воды начинают разрушать кристаллическую решетку поваренной соли, «выдергивая» из нее катионы натрия и анионы хлора с перемещением в водную фазу. Тепловой эффект называют энтальпией решетки, это всегда эндотермическая величина: DН реш>0. Ионы натрия и хлора, оказавшись в воде, вступают с ней во взаимодействие: Na+ + mH2O «Na+ • mH2O CI─ + nH2O «CI─ • nH2O. Речь идет об экзотермической реакции гидратации – реакции взаимодействия с водой. Продукты реакции называются гидратами. Таким образом, от соотношения противоположных по знаку величин энтальпий решетки и гидратации зависит знак теплового эффекта растворения твердого вещества: DН растворения = DН реш + DН гидр. Реакцию гидратации открыл Д.И.Менделеев, автор химической теории растворов. Он первый обратил внимание, что растворение веществ сопровождается тепловыми изменениями и объемными, а это признаки химических реакций, например, разведение этилового спирта в воде сопровождается большим выделением тепла и уменьшением объема: 50 мл спирта + 50 мл воды = 96 мл раствора (!). Исследование процесса гидратации этанола явилось обоснованием состава классической русской водки. Количество молекул воды при гидратации (m,n) называют числом гидратации. Ион окружен молекулами воды за счет сил электростатического притяжения: Рис.5.1 Гидратированный ион натрия. Число гидратации m=6, оно определяется только размером иона. В таком гидратированном виде находятся в воде все ионы. Это гидратная оболочка или «шуба» из молекул воды. Такие соединения с водой непрочные, существуют только в состоянии раствора. Более прочные гидраты образуют некоторые соли, вода входит в состав кристаллической решетки соли и удалить ее можно лишь нагреванием. Например, безводный сульфат меди (II) присоединяет пять молей воды, образуя синий медный купорос: CuSO4 + 5H2O «CuSO4 • 5H2O. Известны железный купорос FeSO4 • 7H2O, глауберова соль Na2SO4 • 12H2O, квасцы и т.д. Гидрат оксида натрия (NaOH) относится к очень прочным гидратам, его можно перегонять без разложения при 1400оС. Соотношение растворенное вещество – растворитель (вода) называют концентрацией раствора. В зависимости от решаемой задачи используются самые разные способы выражения этого соотношения: Масса вещества (г) в расчете на 100г раствора. Например, в 95г воды растворяем 5г хлорида натрия. Масса раствора m= (95 + 5)г, речь идет о 5% NaCI. Существует группа свойств раствора, которые не зависят от природы растворяемого вещества, а определяются только величиной его концентрации. Такие свойства называют общими или коллигативными. 1. Понижение давления пара растворителя над раствором по сравнению с чистым растворителем. Представим себе систему, состоящую из двух одинаковых стаканов. В первый стакан наливается вода, а во второй – такое же количество раствора в воде любого нелетучего вещества. Стаканы помещаем в термостат, изолируем от окружающей среды. Молекулы воды из поверхностного слоя могут покидать ее поверхность и перемещаться в воздух, создавая при равновесии давление насыщенного пара воды (РоН2О), то есть вода испаряется. В случае раствора, часть поверхности воды занята посторонними молекулами или ионами растворенного вещества, давление пара воды (РН2О) будет тем самым снижено на некоторую величину ΔР, зависящую от количества этих посторонних частиц. ΔР = РоН2О — РН2О. В изолированной системе возникает градиент давлений, вода из первого стакана будет переходить через пар во второй стакан до установления состояния равновесия. Из этого обстоятельства следуют важные практические выводы. Рассмотрим диаграмму состояния воды в координатах Р – Т. Рис.5.2 Диаграмма состояния воды. а – давление испарения воды; б – давление пара воды над раствором. На рис.5.2 экспонента (а) характеризует равновесие испарения воды (равновесие ж идкость – г аз), при отрицательных температурах – равновесие сублимации (Т – Г), и, наконец, третья линия отвечает равновесию плавления воды. Реперные точки 0оС – температура плавления воды и 100оС – нормальная температура кипения воды, давление пара воды при этом равно внешнему нормальному давлению 1атм. Давление пара воды над раствором снижено, линия (б) расположена несколько ниже (а), при этом температура плавления Тпл смещается в область отрицательных температур на величину ΔТпл, а температура кипения Ткип – в сторону повышения на ΔТкип. Эффекты пропорциональны моляльности раствора, известны в химии как законы Рауля: ΔТпл = КH2O • m; ΔТкип = EH2O • m. Константы КH2O = 1,86о, EH2O = 0,52о называют соответственно криоскопической и эбулиоскопической постоянными воды. Например, при m=1 моль/кг воды, температура замерзания составит ─ 1,86оС, а температура кипения 100,52оС. Так в технике получают незамерзающие на морозе жидкости (антифризы). Чем выше моляльная концентрация, тем сильнее эффект снижения температуры замерзания. Для достижения максимального эффекта требуется хорошая растворимость вещества в воде и низкая молярная масса, (m получается больше). Чаще всего применяют раствор в воде двухатомного спирта этиленгликоля CH2OH – CH2OH (тосол). 2. Осмос. Осмосом называют одностороннюю диффузию молекул воды через полупроницаемую мембрану. Свойством полупроницаемости, то есть способности пропускать только молекулы воды, а не растворенных в ней веществ, обладают многие материалы – все ткани живого организма, некоторые полимеры, керамика, металлокерамика. Явление изучил впервые Пфеффер в Германии. Его прибор (осмометр) состоял из стакана с водой, в который он погружал трубочку с раствором, на конце которой была натянута мембрана из кожи быка. Рис.5.3 Осмометр Пфеффера. Диффузия молекул воды направлена из стакана в трубку с раствором, в сторону выравнивания концентраций, достижения равновесия. Снизу вверх действует так называемое осмотическое давление (Росм), уровень раствора в трубке поднимается до тех пор, пока Росм не станет равным силе тяжести столба раствора. Пфеффер только успевал подливал воду в стакан. Возникающее давление в соответствии с осмотическим законом Вант-Гоффа численно равно давлению растворенного вещества, если бы оно находилось в состоянии идеального газа при температуре Т и в объеме стакана V: Росм = C• R •T, где С – молярность, моль/л. Выражение совпадает с уравнением состояния идеального газа Менделеева – Клапейрона. Например при концентрации раствора С=1 моль/л осмотическое давление при стандартной температуре составит: Росм = 1• 0,082 • 298 = 24,5 атм (!). Весь межтканевый обмен водой в живом организме протекает по осмотическому механизму. Присутствие в кишечнике большого избытка обычной поваренной соли приведет к немедленному поступлению воды в кишечник из всех других тканей, произойдет потеря клетками воды, то есть их массовая гибель, что называется обезвоживанием организма. Диффузия воды от корневой системы растений вверх к листьям, разбухание древесины при погружении в воду или во влажном воздухе и т.п. – примеров много. Лекция 6. Растворы электролитов Вант-Гоффа очень заинтересовали общие свойства растворов, он начал измерять осмотическое давление, температуры кипения и замерзания различных веществ. Обнаружилось, что законы Рауля и его собственный осмотический закон работают только для веществ типа сахара (неэлектролит). Для водных растворов веществ типа кислот, щелочей, солей (электролиты) экспериментальные свойства в несколько раз превышали рассчитываемые величины – в 2,3 и более (!). Электролитами называют вещества, проводящие электрический ток в расплавленном и растворенном состоянии. Чтобы как то сгладить противоречие, без объяснения причин Вант-Гофф ввел для электролитов поправочный коэффициент i>1, равный единице для случая неэлектролитов. Он так и вошел в историю химии как изотонический коэффициент Вант-Гоффа. Росм =i • C• R •T; ΔТпл = i • КH2O • m; ΔТкип = i • EH2O • m. Физический смысл коэффициента впервые понял швед Сванте Аррениус, создавший свою знаменитую теорию электролитической диссоциации. Смысл его подхода заключается в следующем. Общие свойства растворов зависят только от концентрации. Если осмотическое давление в несколько раз больше, значит концентрация раствора выше. Повышение возможно за счет самопроизвольного распада вещества на составные части (диссоциация на ионы). Образование заряженных частиц в растворе (ионов) приводит к появлению электропроводности: KA «K+ + A─. Положительно заряженная частица K+ называется катионом, а отрицательно заряженная A─ - анионом. Из одного моля электролита КА образуется два моля ионов, осмотическое давление и должно быть в два раза больше. Электролит сложного состава образует еще больше молей при диссоциации, например один моль сульфата алюминия дает пять молей ионов: AI2 (SO4)3 «2AI3+ + 3 SO42─. Причиной распада вещества на заряженные составные части является выгодный экзотермический процесс гидратации водой образующихся ионов. Все соли, не только сульфат алюминия распадаются на катионы металлов и анионы кислотных остатков: NaHCO3 «Na+ + HCO3─ . Кислоты отщепляют катион водорода, щелочи – анион гидроксида: H2SO4 «2H+ + SO42─, KOH «K+ + OH─. Если вещество труднорастворимо в воде, речь идет о равновесии твердой фазы этого вещества с ионами (продуктами диссоциации) в растворе: [(CuOH)2CO3] «2CuOH+ + CO32─. Способность к распаду на ионы у разных веществ различная. В качестве количественной характеристикой процесса часто используют понятие степени диссоциации, представляющее отношение числа распавшихся на ионы молекул электролита в растворе к общему числу его молекул: α= Nрасп/Nобщ(100%). α=0 для неэлектролитов, в случае полного 100%-ного распада, когда α=1 электролит называют сильным, а если α<0,1 – электролит слабый. Точнее, слабым называют электролит, при диссоциации которого устанавливается равновесие: KA «K+ + A─. В растворе имеются как молекулы KA, не распавшиеся на ионы, так и ионы - продукты диссоциации. Запишем выражение для константы равновесия, называемой константой диссоциации электролита: Kд = С K+ • СA─ / СКА. Для слабой двухосновной угольной кислоты можно говорить о двух ступенях диссоциации: H2CO3 «H+ + HCO3─ K1 = 4,7• 10─7 HCO3─ «H+ + CO32─ K2 = 7,0• 10─11. Значения констант показывают, в какой степени угольная кислота является слабым электролитом. На первой ступени основная масса молекул находится в недиссоциированном виде, а на второй ступени диссоциация еще хуже в 10000 раз. Для сильного электролита знаменатель выражения константы диссоциации обращается в ноль, выражение теряет смысл. Константа диссоциации выгодно отличается от степени диссоциации тем, что она не зависит от концентрации электролита. Важно иметь представление о том, какие электролиты сильные, а какие слабые. К сильным кислотам относятся серная H2SO4, азотная HNO3, галогеноводородные HCI, HBr, HI, хлорная HCIO4, все остальные кислоты слабые. Сильные основания – NaOH, KOH, CsOH, LiOH, Ba(OH)2, остальные гидроксиды металлов III- V групп – слабые. Все соли – электролиты сильные. Допустим, имеем слабый электролит KA с исходной концентрацией С (моль/л) и степенью диссоциации α. В числителе выражения константы диссоциации С K+ = СA─ = С •α. В растворе останется молекул электролита, не распавшихся на ионы СКА= С – С α: Kд = С2 α2 / С(1 – α). Величиной α в знаменателе можно пренебречь, поскольку она гораздо меньше единицы для слабого электролита: Kд = С • α2, α = √ Kд/C. При снижении концентрации раствора, то есть при разбавлении его водой, степень диссоциации всегда растет: при С→0, α→1. В бесконечно разбавленном растворе любой слабый электролит становится сильным (закон разведения). Сильные электролиты имеют свою отличительную особенность. Степень диссоциации равна единице, в растворе нет недиссоциированных на ионы молекул. Ионов в растворе оказывается слишком много, каждый из этих ионов несет на себе гидратную шубу, они мешают друг другу, их перемещение в растворе ограничено, затруднено.Степень диссоциации электролита экспериментально определяют путем измерения электропроводности раствора: α = λv / λ∞, где λv – удельная электропроводность раствора конечной концентрации, λ∞ - то же в бесконечно разбавленном растворе. Готовят ряд растворов со снижением концентрации, измеряют их электропроводность и экстраполяцией зависимости на нулевую концентрацию находят знаменатель. Поскольку подвижность ионов в растворе ограничена, получают все время заниженную степень диссоциации меньше единицы. Такая экспериментально определяемая величина α сильного электролита называется кажущейся степенью диссоциации. Из-за таких искажений вместо концентрации используют величину активности иона: a = γ c, где с – концентрация, а γ – коэффициент активности. В реальном растворе γ<1, по мере разбавления подвижность ионов растет, искажения ослабевают, раствор приближается к идеальному и а → с, а γ → 1. Аналогично в идеальном газе пользуются парциальным давлением (Р), а выше 2атм, когда отклонения от идеальности становятся заметными, пользуются понятием фугитивности, связанной с давлением через коэффициент фугитивности: Перейдем к рассмотрению наиболее интересных примеров равновесий в растворах электролитов. 1. Условия смещения ионных равновесий. Равновесия в растворах электролитов – это равновесия между ионами. Если к раствору NaCI добавить K2SO4 получатся равновесная смесь ионов. Химической реакции между солями нет. Но если заменить хлорид натрия на хлорид бария, пойдет реакция слева направо с образованием осадка труднорастворимого сульфата бария (бариевое молоко): Ba2+ + SO4 2─ «BaSO4↓ →→→→ Аналогично смещения равновесия вправо по принципу Ле-Шателье вызывает выделение газообразного продукта или образование слабого электролита: 2HCI + Na2S «2NaCI + H2S ↑ 2H+ + S2─ «H2S ↑ →→→→ HCI + NaOH «NaCI + H2O H+ + OH─ «H2O →→→→ Любая реакция нейтрализации есть процесс образования воды. 2. Произведение растворимости (ПР). Рассмотрим труднорастворимый сильный электролит, например сульфат бария. [BaSO4] «Ba2+ + SO4 2─ Константа такого равновесия может быть записана в виде: К = С Ba2+ • С SO4 2─ / С BaSO4. В знаменателе концентрация вещества в твердом состоянии, это фаза постоянного состава, поэтому объединяем знаменатель с константой равновесия: К• С BaSO4 = ПР= С Ba2+ • С SO4 2─. Произведение концентраций ионов называется произведением растворимости (ПР) труднорастворимого электролита. Это константа равновесия, которая зависит от температуры и определяет соотношение концентраций ионов электролита в растворе. В таблице 6.1 приведены значения этих величин для некоторых электролитов при 18оС. Таблица 6.1 Произведения растворимости (ПР) Из приведенных данных хорошо видно, что понятие «нерастворимость» колеблется в очень широких пределах и разница может составлять десятки порядков. Эти табличные значения позволяют выполнять сложные расчеты с участием нерастворимых в воде веществ, например, завод выделяет серебро из технологического раствора в виде осадка хлорида. Много ли при этом серебра останется в растворе, то есть, каковы будут потери? AgCI «Ag+ + CI─, ПР = С Ag+ • С CI─. = 1,7•10─10, при этом концентрации ионов серебра и хлора равны в соответствием с уравнением распада на ионы. С Ag+ = √ ПР = √1,7•10─10 = 1,3•10─5 моль/л = 1,5•10─3 г/л = 1,5 мг/л. В каждом литре технологического раствора будет содержаться 1,5 мг серебра. Конечно, это много, если учесть, что объемы раствора могут составлять сотни кубических метров только за сутки. Для снижения потерь можно выбрать осадок серебра с меньшим произведением растворимости, или добавить в раствор ионов хлора. По принципу Ле-Шателье равновесие диссоциации серебра смещается влево, то есть серебро принудительно выводят в осадок из раствора. Речь идет о так называемом эффекте высаливания. 3. Диссоциация воды. Водородный показатель рН. Чистая вода практически не проводит ток, это очень слабый электролит. Степень ее электролитической диссоциации α= 1,8 • 10─9. Это означает, на ионы распадается одна молекула воды из 555000000 штук (!). Запишем уравнение ее диссоциации и выражение для константы равновесия процесса: H2O «H+ + OH─ K = C H+ • C OH─ / C H2O. Молярная концентрация воды C H2O = 1000г/ 18 г/моль = 55,5 моль/л. Слишком большая величина, чтобы ощутить ее изменение при распаде воды на ионы. Объединяем с константой равновесия: K • C H2O =Kw =C H+ • C OH─. Новая константа Kw называется ионным произведением воды. При 22оС Kw= 1 • 10─14. В любой водной системе произведение концентраций ионов водорода и гидроксила равно ионному произведению воды. В чистой воде по уравнению диссоциации концентрации этих ионов равны: C H+ = C OH─ = √10─14 = 10─7 моль/л. Такая водная среда называется нейтральной. При добавлении в воду раствора кислоты увеличивается концентрация ионов водорода, а ионов гидроксила становится соответственно меньше, так чтобы их произведение равнялось Kw. Это среда кислая: CH+ >10─7 моль/л. В случае избытка гидроксильных ионов наоборот CH+ <10─7 моль/л, а среда называется щелочной. Удобнее использовать логарифмическую шкалу, то есть не называть не саму величину концентрации, а ее порядок. Логарифмируем выражение ионного произведения воды и меняем знак: C H+ • C OH─ = 10─14, ─ lg C H+ ─ lg C OH─ = 14 ─ lg C H+ = рН, а ─ lg C OH─ = рОН – показатели концентраций. рН + рОН = 14. Чаще используют показатель концентрации ионов водорода – водородный показатель. Изменение концентрации ионов водорода на порядок приводит к изменению рН на единицу. В нейтральной среде рН = ─ lg C H+ = ─ lg 10─7 = 7. В кислой среде рН < 7, а в щелочной рН > 7. Так выглядит шкала кислотности сред в единицах рН. Например, определим значение рН 1М НCI. Соляная кислота сильная, степень диссоциации равна единице. Молярная концентрация кислоты равна концентрации ионов водорода: С HCI = C H+ = 1 моль/л. рН = ─ lg1 =0. Чтобы получить рН = ─1, нужна 10М HCI. Измеряют рН на специальном электрохимическом приборе рН-метре. Менее точно рН определяется универсальным индикатором, меняющим цвет при каждом изменении рН на единицу (12 цветов в области рН = 0-12). 4. Гидролиз солей. Гидролиз – химическое взаимодействие солей с водой, которое приводит к образованию более слабого электролита, чем исходная соль с изменением рН среды. Такое взаимодействие имеет место не во всех случаях, например, поваренная соль имеет нейтральную реакцию среды, потому что единственным слабым электролитом в системе является вода, равновесие полностью смещено влево: NaCI + H2O «HCI + NaOH, рН=7 ←←←← Но как только в составе соли появляется слабая кислота или слабое основание, картина сразу меняется. Допустим, что соль образована слабой угольной кислотой (Н2СО3) и сильным гидроксидом натрия (NaOH). С водой взаимодействует карбонатный анион следующим образом. Вода при диссоциации образует ионы водорода и гидроксила. Ион водорода связывается карбонатным анионом, образуя более слабый электролит – гидрокарбонатный анион. По принципу Ле-Шателье равновесие диссоциации воды смещается вправо, при этом образуются новые ионы водорода для реакции с карбонат-анионом, а в растворе накапливаются гидроксильные анионы, рН тем самым повышается и среда становится щелочной: Na2CO3 + H2O «NaHCO3 + NaOH; CO32─ + H2O «HCO3─ + OH─; H2O «H+ + OH─. →→→→→→ рН > 7. На второй ступени гидрокарбонатный анион также может подвергаться гидролизу с выделением углекислого газа из образующейся угольной кислоты, но процесс развивается только при нагревании: Т NaHCO3 + H2O «H2CO3 + NaOH ↓ H2O + СО2 ↑. Если соль образована слабым основанием и сильной кислотой, гидролизу подвергается катион металла, среда становится кислой: FeCI3 + H2O «FeOHCI2 ↓ + HCI; Fe3+ + H2O «FeOH2+ + H+; H2O «H+ + OH─. →→→→→→ рН < 7. Наконец, в случае, когда в составе соли и кислота, и основание слабые, при гидролизе аниона образуется щелочь, при гидролизе катиона – кислота, они взаимно нейтрализуют друг друга и все равновесия смещаются вправо. Происходит полный необратимый гидролиз: Fe2(CO3)3 + H2O → Fe(OH)3↓ + CO2 ↑. Это так называемые легкогидролизующиеся вещества, которые не могут находиться в контакте с водой, они полностью разлагаются водой, даже атмосферной. Такие вещества хранят и с ними можно работать только в специальных сухих боксах или в вакууме. В таблице растворимости для этих веществ обычно указывают прочерк. Гидролиз усилен в разбавленных растворах, при нагревании (процесс с поглощением тепла). Если гидролиз нужно подавить, используют принцип Ле-Шателье. Например, приготовлен раствор хлорида железа FeCI3 стандартной концентрации 1 моль/л. Через некоторое время в результате гидролиза, выпадает осадок основной соли, в растворе железа стало меньше, концентрация изменила значение, раствор уже не тот, что же делать? Чтобы сделать его устойчивым к хранению без гидролиза, в исходный раствор подливают соляной кислоты, создают кислую среду. Равновесие гидролиза смещается влево. Лекция 7. Растворы электролитов, продолжение. 5. Кислотно-основные индикаторы. Обнаружить кислоту или щелочь в растворе очень просто можно с помощью индикатора. Рассмотрим работу такой системы на примере метилового оранжевого (метилоранжа). Это слабая органическая кислота, анион которой окрашен в желтый цвет, а исходная недиссоциированная форма – в красный: HA «H+ + A─. Красный цвет в смеси с желтым дает оранжевый – исходную окраску индикатора. При добавлении раствора кислоты, то есть ионов водорода, равновесие диссоциации по принципу Ле-Шателье смещается влево, в сторону красной недиссоциированной формы. При добавлении щелочи ионы гидроксила связывают ионы водорода и равновесие диссоциации индикатора смещается вправо – раствор становится желтым. При смешивании 5-6 Дата добавления: 2013-12-12; Просмотров: 1874; Нарушение авторских прав?; Мы поможем в написании вашей работы!
Вещество
Состояние
DНо298,
КДж/моль
So298,
Дж/моль·К
Вещество
Состояние
DНо298,
КДж/моль
So298,
Дж/моль·К
AI2O3
Тв
-1675
50,94
H2
Газ
130,6
AI2(SO4)3
Тв
-3434
239,2
H2O
Газ
-241,84
188,74
C
Тв
(графит)
5,74
H2O
Жидк
-285,84
69,96
СО
Газ
-110,5
197,4
Н2О2
Жидк
81,35
75,91
СО2
Газ
-393,5
213,6
I2
Тв
116,6
CS2
Газ
115,3
237,8
HI
Газ
25,94
206,3
CH4
Газ
-74,85
186,19
MgO
Тв
-601,24
26,94
С2Н2
Газ
226,75
200,8
Mn
Тв
31,7
С2Н4
Газ
52,28
219,4
MnCI2
Тв
-482,0
117,0
С2Н6
Газ
-84,67
229,5
N2
Газ
191,5
С3Н8
Газ
-103,9
269,9
NO
Газ
90,37
210,62
CH3OH
Жидк
-238,7
126,7
NO2
Газ
33,89
240,45
С2Н5ОН
Жидк
-277,5
-
N2O4
Газ
9,37
304,3
СаО
Тв
-635,1
39,7
NH3
Газ
-45,98
192,28
Са(ОН)2
Тв
-986,5
83,4
NH4CI
Тв
-315,39
94,5
CI2
Газ
223,0
О2
Газ
205,03
HCI
Газ
-92,31
186,7
SO2
Газ
-297,78
248,29
Fe
Тв
27,56
SO3
Газ
-395,01
255,98
Fe2O3
Тв
-821,32
89,96
SiO2
Тв
(кварц)
-859,3
42,09
Fe3O4
Тв
-1117,7
151,46
H2S
Газ
-20,06
205,45
Вещество
ПР
Вещество
ПР
Вещество
ПР
AgCI
1,7•10─10
CaSO4 •2H2O
6,1•10─5
HgS
3,0•10─53
AgI
8,5•10─17
Cd(OH)2
1,2•10─4
MgCO3
1,0•10─5
Ag2S
1,0•10─51
Co(OH)2
2,0•10─16
Ni(OH)2
1,6•10─14
AgOH
2,0•10─8
Cr(OH)3
5,4•10─31
PbCI2
1,7•10─5
AI(OH)3
1,99•10─33
Cu(OH)2
5,6•10─20
PbS
1,1•10─29
BaSO4
1,08•10─10
CuS
4,0•10─38
PbSO4
2,2•10─8
Bi2S3
1,6•10─72
Fe(OH)2
4,8•10─16
Zn(OH)2
4,5•10─17
CaCO3
4,8•10─9
Fe(OH)3
3,8•10─38
ZnS
7,0•10─24