
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов
|
|
|
|
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с p- электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
| Hd+ ® | 
|
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.

| OH + 2Na ® | 
| ONa(фенолят натрия) + H2 |

| OH + NaOH « | 
| ONa + H2O |
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:

| ||||||

| OH + FeCl3 « | 
| O–Fe | + 3 HCl | ||

|
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:

| ONa + H2SO4 ® | 
| OH + NaHSO4 |

| ONa + CO2 + H2O ® | 
| OH + NaHCO3 |
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры

| O | Na + Br- | -CH2–CH3 ® | 
| O–CH2–CH3(этилфениловый эфир) + NaBr |
и сложные эфиры
| O II | O II | |||||

| O | H + Cl- | -C–CH3(хлорангидрид укс.кислоты) ® | 
| O– | C–CH3(фениловый эфир укс.кислоты) + HCl |
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
| OH | OH | OH | ||||

| + 3H2O | 3HNO3 ¬––– H2SO4 | 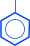
| 3Br2 –––® | 
| + 3HBr |
| NO2 | Br | |||||
| 2,4,6 – тринитро- фенол (пикриновая кислота) | 2,4,6–трибром- фенол |
3. Гидрирование.
| OH | OH | |

| 3H2 ––® Ni |  (циклогексанол) (циклогексанол)
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1131; Нарушение авторских прав?; Мы поможем в написании вашей работы!