
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация воды. Водородный показатель
|
|
|
|
Вода, являясь очень слабым электролитом, в незначительной степени диссоциирует с образованием ионов водорода и гидроксид-ионов:
Н2О ↔ Н+ + ОН‾ (1)
Прилагая к этому равновесию закон действия масс, получаем:
K = 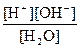 , или
, или
К ∙ [H2O] = [H+][OH‾], (2)
где К – константа диссоциации воды, равная 1,8∙10-16 (при 22 0С).
Учитывая, что степень диссоциации воды очень мала, концентрацию недиссоциированных молекул воды [H2O] можно считать величиной постоянной и приравнять к общему количеству воды, заключающемуся в 1 л ее, т.е. можно принять, что
[H2O] = 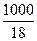 = 55,56 моль/л.
= 55,56 моль/л.
Произведение двух постоянных величин К и [H2O] есть величина постоянная, поэтому заменим его новой константой:
К ∙ [H2O] = 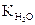 . Численное значение
. Численное значение 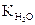 1,8∙10-16 ∙ 55,56 = 10-14.
1,8∙10-16 ∙ 55,56 = 10-14.
Теперь выражение (2) можно представить так:
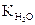 = [H+][OH‾] = 10-14 (3).
= [H+][OH‾] = 10-14 (3).
Отсюда [H+][OH‾] = 10-14 (4)
Для воды и разбавленных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная и называется ионным произведением воды
Из соотношения (4) вытекает, что
[H+] = 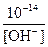 моль/ л; [OH‾] =
моль/ л; [OH‾] = 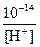 моль/ л.
моль/ л.
В нейтральных растворах [H+] = [OH‾] = 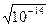 = 10-7 моль/ л. В кислых ─ [H+] > [OH‾], в щелочных ─ [H+] < [OH‾].
= 10-7 моль/ л. В кислых ─ [H+] > [OH‾], в щелочных ─ [H+] < [OH‾].
Для характеристики реакции среды (кислая, щелочная, нейтральная) удобнее пользоваться не концентрациями ионов Н+ и ОН‾, а их десятичными логарифмами, взятыми с обратным знаком. Эти величины обозначаются символами рН и рОН и называются соответственно водородным и гидроксильным показателями:
рН = -lg [H+]; рОН = -lg [ОH‾]
В нейтральной среде рН = 7, в кислой ─ рН < 7, в щелочной ─ рН > 7
Логарифмируя соотношение [H+][OH‾] = 10-14 и меняя знаки на обратные, получаем:
рН + рОН = 14.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 353; Нарушение авторских прав?; Мы поможем в написании вашей работы!