
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Одновалентные металлы основных солей не образуют
|
|
|
|
Одноосновные кислоты кислых солей не образуют.
С О Л И
Соли – это продукты частичной или полной замены атомов водорода в кислоте на атомы металла, или продукты частичной или полной замены гидроксогрупп в основаниях на кислотные остатки.
 |
H2SO4 Cu(OH)2
NaHSO4 Na2SO4 CuOHCl CuCl2
Соли бывают:
1. Средние – а) это продукты полной замены атомов водорода в кислоте на металл,
гидроксогрупп в основаниях на кислотные остатки.
б) это сложные вещества, состоящие из атомов металлов и кислотных
остатков.
Na2SO4, NaCl, Ca3(PO4)2.
2. Кислые – а) это продукты частичной замены атомов водорода в кислоте на металл.
б) это сложные вещества, состоящие из атомов металлов, атомов водорода
и кислотных остатков.
Гидросульфат натрия - NaHSO4
Названия кислым солям дают следующим образом:
Атом водорода называют приставкой гидро-, затем дают название кислотному остатку и атому металла.
3. Основные – а) это продукты частичной замены гидроксогрупп в основаниях на
кислотные остатки.
б) это сложные вещества, состоящие из атомов металлов,
гидроксогрупп, кислотных остатков.
Гидроксохлорид меди (II) - CuOHCl
Названия основным солям дают с использованием приставки гидроксо-, затем называют кислотный остаток и атомы металлов.
4. Двойные – соли, содержащие в своем составе два или несколько видов атомов металлов и кислотные остатки:
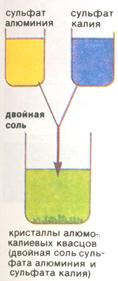
| KCr(SO4)2 | KAl(SO4)2 | MgNH4PO4 |
| хромокалиевые квасцы сульфат калия, хрома (III). | алюмокалиевые квасцы сульфат калия, алюминия. | магния, аммония фосфат. |
5. Комплексные – соли, содержащие комплексный ион:
[Ag(NH3)2]Cl
хлорид диамминсеребра
Получение средних солей:
Средние соли получают при взаимодействии:
1. оснований с кислотами:
KOH + HNO3 → KNO3 + H2O
2. кислот с основными оксидами:
H2SO4 + CuO →CuSO4 + H2O
3. кислот с солями:
H2S + CuCl2 → CuS↓ + 2HCl
4. двух различных солей:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
5. щелочей с солями:
3КOH + FeCl3 → 3KCl + Fe(OH) 3↓
6. оснований с кислотными оксидами:
Сa(OH)2 + CO2 → CaCO3↓ + H2O
7. основных оксидов с кислотными:
CaO + SiO2 → CaSiO3
8. металлов с неметаллами:
2K + Cl2 → 2KCl
9. металлов с кислотами:
2Al + 6HCl → 2AlCl3 + 3H2↑ (См. электрохимический ряд напряжений металлов)
10. металлов с солями:
 а) Fe + CuSO4 → FeSO4 + Cu
а) Fe + CuSO4 → FeSO4 + Cu
 б) FeSO4 + Cu (См. электрохимический ряд напряжений металлов)
б) FeSO4 + Cu (См. электрохимический ряд напряжений металлов)
11. основных солей с кислотами:
MgOHCl + HCl → MgCl2 + H2O
12. при разложении кислых солей:
t
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Получение кислых солей:
Кислые соли получают при взаимодействии:
1. оснований с избытком многоосновных кислот:
NaOH + H2SO4 → NaHSO4 + H2O
избыток
2. средних солей с кислотами, кислотный остаток которых входит в состав соли:
Na2SO4 + H2SO4 → 2NaHSO4
3. ангидридов в избытке со щелочами или с солями:
а) СО2 + NaOH → NaHCO3
избыток
б) СО2 + Na2CO3 + H2O → 2NaHCO3
4. при получении соляной кислоты, при низкой температуре (450оС) образуется кислая соль:
t = 450oC
 NaCl + H2SO4 NaHSO4 + HCl
NaCl + H2SO4 NaHSO4 + HCl
Получение основных солей:
Основные соли получают при взаимодействии:
1. кислот с избытком оснований:
HCl + Mg(OH)2 → MgOHCl + H2O
избыток
2. средних солей со щелочами:
Bi(NO3) 3 + 2NaOH → Bi(OH)2NO3 + 2NaNO3
(недостаток) дигидроксонитрат висмута (III)
Химические свойства солей:
Соли вступают в химические реакции с:
1. металлами:
 Fe + CuSO4 → Cu + FeSO4
Fe + CuSO4 → Cu + FeSO4
 Cu + FeSO4 (См. электрохимический ряд напряжений металлов)
Cu + FeSO4 (См. электрохимический ряд напряжений металлов)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 906; Нарушение авторских прав?; Мы поможем в написании вашей работы!