
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярная концентрация (СМ) моль/л
|
|
|
|
Задача №6.
Задача №5.
Задача №4.
Задача №3.
Задача №2.
Задача №1.
Способы выражения концентрации растворов
1. Массовая доля вещества:
m (вещества)
 W =
W =
m (раствора)
Массовую долю вещества можно выразить в процентах (процентная концентрация), то тогда формула будет выглядеть:
m (вещества)
 W = • 100%
W = • 100%
m (раствора)
Расчёты на массовую долю ведут с точностью до сотых долей.
Определить массовую долю хлорида натрия в растворе, если в 400 граммах раствора содержится 20 грамм хлорида натрия.
 Дано: Решение:
Дано: Решение:
m(р-ра) = 400г m (вещества)
 m (NaCl) = 20г W = • 100%
m (NaCl) = 20г W = • 100%
 m (раствора)
m (раствора)
W -? 20г
 W = • 100% = 5%
W = • 100% = 5%
400г
Ответ: W=5%
Определить массовую долю хлорида натрия в растворе, если в 400 граммах воды содержится 20 грамм хлорида натрия.
 Дано: Решение:
Дано: Решение:
m(воды) = 400г 1. Необходимо найти массу раствора.
m (NaCl) = 20г m (р-ра) = m (воды) + m (NaCl) = 400г+ 20г = 420г
 W -? m (вещества)
W -? m (вещества)
 2.W = • 100%
2.W = • 100%
m (раствора)
20г
 W = • 100% = 4,76%
W = • 100% = 4,76%
420г
Ответ: W=4,76%
 Приготовить 500г раствора нитрата натрия с массовой долей 2%. Описать ход приготовления раствора.
Приготовить 500г раствора нитрата натрия с массовой долей 2%. Описать ход приготовления раствора.
Дано: Решение:
m(р-ра) = 500г 1. Находим массу нитрата натрия
W = 2% m (вещества)

 m(NaNO3) -? W = • 100%
m(NaNO3) -? W = • 100%
V(H2O)-? m (раствора)
Ход приготов-
ления р-ра-?
W• m (р-ра)
 m (в-ва)=
m (в-ва)=
100%
2• 500г
 m (NaNO3)= = 10г
m (NaNO3)= = 10г
100%
2. Определяем объём воды
m(H2O) = m(р-ра) – m(в-ва)= 500г – 10г = 490г
V(H2O)=490мл
Ответ: m(NaNO3) = 10г, V(H2O)=490мл
Ход приготовления неточного раствора:
1. Мерным цилиндром отмериваем 490мл воды очищенной.
2. Переливаем отмеренную воду в химический стакан.
3. Отвешиваем на аптечных весочках 10г NaNO3.
4. Пересыпаем отвешенный NaNO3 в химический стакан с водой и полностью растворяем.
Задачи на смешение растворов можно решить по правилу «креста» (диагональной схеме). Пишется косой крест, с левой стороны записывают исходные концентрации, в месте пересечения линий креста записывают концентрацию, которую необходимо получить. С правой стороны по ходу линии креста записывают разницу между большей концентрацией и меньшей в весовых частях.
В каком соотношении следует смешать 80% и 30% растворы, чтобы получить 300г раствора с массовой долей 70%?
 Дано: Решение:
Дано: Решение:
w1=80% 1. Составляем диагональную схему (пишем косой крест)


 w2=30% 80% 40вч=4вч
w2=30% 80% 40вч=4вч
w3=70% 70%
 m3=300г 30% 10вч=1вч
m3=300г 30% 10вч=1вч
 m1 (80%р-ра)-? 2. Находим сумму в весовых частях
m1 (80%р-ра)-? 2. Находим сумму в весовых частях
m2 (30%р-ра)-? 4вч + 1вч = 5вч
3. Определяем массу 30% раствора
300 г (р-ра) – 5вч
х г (р-ра) – 1вч
300г•1вч
х = ------------- = 60г
5вч
4. Определяем массу 80% раствора
300г – 60г = 240г
Ответ: m1 (80% р-ра) = 240г
m2 (30% р-ра) = 60г
2. Молярная концентрация – это величина равная отношению количества растворенного вещества к объему раствора:
n(x)
 C(x) =, где C(x) – молярная концентрация вещества x,
C(x) =, где C(x) – молярная концентрация вещества x,
V n(x) – количество частиц x,
V – объем раствора.
Молярная концентрация – концентрация, показывающая сколько молей растворенного вещества содержится в 1 л раствора.
Молярную концентрацию обозначают М (моль/л).
К точным растворам относят растворы с молярной концентрацией и молярной концентрацией эквивалента. Расчёты в них ведут с точностью до четвёртого знака после запятой.
Приготовить 500мл раствора сульфата натрия с молярной концентрацией 0,2. Описать ход приготовления раствора.
 Дано: Решение:
Дано: Решение:
V(р-ра) = 500мл 1 способ решения:
СМ = 0,2 моль/л 1. Находим относительную молекулярную массу сульфата натрия.
 Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
m(Na2SO4) -? 2. Составляем пропорцию и определяем массу сульфата натрия.
ход приготовления В 1000мл 1М раствора – 142г Na2SO4
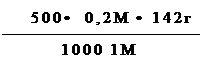 точного раствора -? В 500мл 0,2М раствора – хг Na2SO4
точного раствора -? В 500мл 0,2М раствора – хг Na2SO4
х = = 14,2000г
2 способ решения:
1. Находим относительную молекулярную массу сульфата натрия.
Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
2. Массу сульфата натрия можно определить по формуле:
CМ • Mr • V 0,2 • 142 • 500

 m = = = 14,2000г
m = = = 14,2000г
1000 1000
Ответ: m(Na2SO4) = 14,2000г.
Ход приготовления точного раствора:
1. На аптечных весочках отвешиваем 14,20г сульфата натрия (точность взвешивания на аптечных
весочках сотые доли грамма).
2. Навеску уточняем на аналитических весах.
3. В мерную колбу объёмом 500мл наливаем 1/3 часть воды очищенной.
4. Пересыпаем в колбу отвешенный сульфат натрия и полностью растворяем.
5. Наливаем воды очищенной в колбу, не доходя до метки 500мл примерно 1см.
6. Держим метку на уровне глаз и последний сантиметр откапываем пипеткой.
7. Смотрим по нижнему краю мениска, так как раствор неокрашенный.
Примечание: если готовят раствор окрашенный, то смотрят по верхнему краю мениска.
3. Молярная концентрация эквивалента (нормальная концентрация) – это концентрация, показывающая, сколько эквивалентов вещества содержится в 1 литре раствора.
Молярную концентрацию эквивалента обозначают CN или М(1/Z x) моль/л.
Эквивалент – величина, показывающая, сколько весовых частей вещества может соединиться с 8 весовыми частями кислорода или 1 весовой частью водорода.
Эквивалент обозначают буквой Э, эквивалент безмерная величина.
Ar (Mr)
 Э простого вещества =
Э простого вещества =
фактор эквивалентности
Фактор эквивалентности – это величина, равная произведению валентности элемента на его индекс:
Например,
II 16 • 2 I 23

 Э(O2) = = 8; Э(Na) = = 23
Э(O2) = = 8; Э(Na) = = 23
2 • 2 1
Mr
 Э сложного вещества =
Э сложного вещества =
фактор эквивалентности элемента,
стоящего на 1 месте в формуле.
II 64 + 16 80

 Э(CuO) = = = 40
Э(CuO) = = = 40
2 2
II 2 + 64 + 32 98

 Э(Cu(OH) 2) = = = 49
Э(Cu(OH) 2) = = = 49
2 2
I 2 + 32 + 4 • 16 98

 Э(H2SO4) = = = 49
Э(H2SO4) = = = 49
2 2
III 27 • 2 + 3 • (32 + 4 • 16) 342

 Э(Al2 (SO4)3) = = = 57,0
Э(Al2 (SO4)3) = = = 57,0
6 6
Приготовить 500мл раствора сульфата натрия с молярной концентрацией эквивалента 0,2. Описать ход приготовления раствора.
 Дано: Решение:
Дано: Решение:
V(р-ра) = 500мл 1 способ решения:
СN = 0,2 моль/л 1. Находим относительную молекулярную массу сульфата
натрия.
 Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
|
Ход приготовления
точного раствора -?
2. Находим эквивалент сульфата натрия:
Mr 142

 Э (Na2SO4) = = = 71
Э (Na2SO4) = = = 71
2 2
3. Составляем пропорцию и определяем массу сульфата натрия.
В 1000мл 1N раствора – 71г Na2SO4
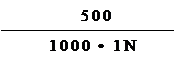 В 500мл 0,2N раствора – хг Na2SO4
В 500мл 0,2N раствора – хг Na2SO4
х = = 7,1000г
2 способ решения:
1. Находим относительную молекулярную массу сульфата натрия.
Mr (Na2SO4) = 23 • 2 + 32 + 16 • 4= 142
|
2. Находим эквивалент сульфата натрия:
Mr 142

 Э (Na2SO4) = = = 71
Э (Na2SO4) = = = 71
2 2
3. Массу сульфата натрия можно определить по формуле:
CN • Э • V 0,2 • 71 • 500

 m = = = 7,1000г
m = = = 7,1000г
1000 1000
Ответ: m(Na2SO4) = 7,1000г.
Ход приготовления точного раствора:
1. На аптечных весочках отвешиваем 7,10г сульфата натрия (точность взвешивания на
аптечных весочках сотые доли грамма).
2. Навеску уточняем на аналитических весах.
3. В мерную колбу объёмом 500мл наливаем 1/3 часть воды очищенной.
4. Пересыпаем в колбу отвешенный сульфат натрия и полностью растворяем.
5. Наливаем воды очищенной в колбу, не доходя до метки 500мл примерно 1см.
6. Держим метку на уровне глаз и последний сантиметр откапываем пипеткой.
7. Смотрим по нижнему краю мениска, так как раствор неокрашенный.
Расчетные формулы по теме: «Концентрация растворов»
Массовая доля (W)
1. m (вещества) 3. CN • Э

 W = • 100% W =
W = • 100% W =
m (раствора) 10 • ρ
2. CМ • Mr 4. W1 m2


 W = =
W = =
10 • ρ W2 m1
5. V1 W2

 =
=
V2 W1
1. 10 • W • p
 СМ =
СМ =
Mr
2. m • 1000
 СМ =
СМ =
Mr • V
CМ • Mr • V
 m =
m =
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 3635; Нарушение авторских прав?; Мы поможем в написании вашей работы!