
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакция Гарриуса
|
|
|
|
Разложение.
Горение.
Реакции окисления.
t=300˚C, k=Ag
а) 2СH2 = CH2 + O2 ———————→ 2CH2 — CH2
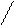

O
этоксиэтан
Этилен горит светящися пламенем с образованием СО2 и Н2О, слегка коптящим пламенем.
t
а) С2Н4 + 3О2 ————→ 2СО2↑ + 2Н2О (в струе кислорода)
избыток
t
б) С2Н4 + 2О2 ————→ СО2↑ + 2Н2О + С (горение на воздухе)
недостаток
t
С2Н4 —————→ 2С + 2Н2↑
8.Реакция полимеризации.
H H
t,k │ │
а) n H2C = CH2 ——————→ (— C — C—) n
│ │
H H
полиэтилен
t,k
б) n CH2 = CH —————→ (—CH2—CH—) n
│ │
CN CN
акрилонитрил полиакрилонитрил
t менее 20˚С
Н3С—СН = СН2 + О3 ———————→ Н3С — СН — О — СН2 + Н2О →
│ │
О———— О озонид
О О
// //
——→ СН3 — С + Н — С + Н2О2
Н Н
этаналь метаналь пероксид водорода
Озониды — сильно взрывчатые вещества.
Качественные реакции на непредельные углеводороды (реакции на двойную связь).
1. Реакция окисления (реакция Вагнера,обесцвечивание раствора КMnО4)
а) в нейтральной среде:
3СН2 = СН2 + 2КМnO4 + 4H2O——→3CH2OH — CH2OH + 2MnO2↓ + 2KOH
этилен фиолетовый этиленгликоль буров. цв.
раствор
б) в щелочной среде:
С2Н4 + 2KOH + 2KМnO4 ———→ C2H6O2 + 2K2MnO4
перманганат этиленгликоль манганат калия
калия (р-р. зелёного цвета)
2. Обесцвечивание избытка брома в бромной воде
Н2С = СН2 + Br2 ———→ CH2 — CH2
│ │
Br Br
1,2 дибромэтан
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 380; Нарушение авторских прав?; Мы поможем в написании вашей работы!