
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И направление самопроизвольных процессов
|
|
|
|
Термодинамические потенциалы
Абсолютное значение энтропии газа.
Абсолютная значение энтропии газа рассчитывается:
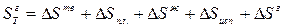 ,
,
где Δ Sж – изменение энтропии жидкости при нагревании ее от Т пл. до температуры кипения Т кип.; Δ Sисп – изменение энтропии при испарении жидкости; Δ Sг – изменение энтропии при нагревании газа от Т кип до температуры Т. Тогда
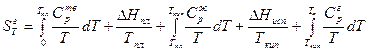 .
.
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных: если в результате расчета окажется, что D S > 0, процесс пойдет самопроизвольно, при D S = 0 – состояние равновесия, если D S < 0, процесс самопроизвольно протекать не будет.
На практике приходится иметь дело преимущественно с системами, взаимодействующими с окружающей средой. В качестве критерия оценки направления самопроизвольных процессов в таких системах используются термодинамические потенциалы.
Термодинамическим потенциалом называют функцию состояния, убыль которой в обратимо протекающем процессе при постоянстве определенных параметров равна максимальной полезной работе.
Наибольшее значение имеют два основных термодинамических потенциала: энергия Гельмгольца F (T, V) и энергия Гиббса G (T, p). В скобках указаны параметры, функциями которых являются термодинамические потенциалы.
Чтобы получить представление о термодинамических потенциалах, воспользуемся объединенным математическим выражением первого и второго законов термодинамики.
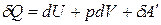 .
.
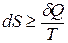 или
или 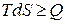 .
.
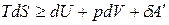 ,
,
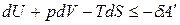 . (1.23)
. (1.23)
Рассмотрим соответствующие процессы.
И з о б а р н о – и з о т е р м и ч е с к и й п р о ц е с с (p, T = const).
Уравнение (1.23) запишется
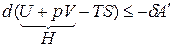 ,
,
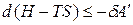 ,
,
где H – TS = G –свободная энергия Гиббса. При p, T = const изменение энергии Гиббса связано с выполнением полезной работы:
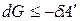 .
.
В обратимо протекающем процессе 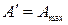 . Тогда
. Тогда
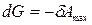 ,
,
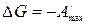 .
.
Таким образом, свободная энергия Гиббса является изобарно-изотермическим потенциалом, так как ее уменьшение характеризует максимальную работу этого процесса.
Если единственным видом работы является работа расширения (сжатия), т.е. 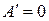 , то в необратимом, а, следовательно, самопроизвольно протекающем процессе
, то в необратимом, а, следовательно, самопроизвольно протекающем процессе
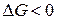 . (1.24)
. (1.24)
И з о х о р н о – и з о т е р м и ч е с к и й п р о ц е с с (V, T = const).
Уравнение (1.23) примет вид
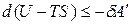 ,
,
где U – TS = F – свободная энергия Гельмгольца. При V, T = const изменение энергии Гельмгольца связано с выполнением полезной работы:
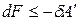 .
.
В обратимо протекающем процессе
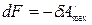 ,
,
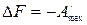 .
.
Таким образом, свободная энергия Гельмгольца является изохорно-изотермическим потенциалом.
Если 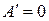 , то в самопроизвольно протекающем процессе
, то в самопроизвольно протекающем процессе
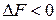 . (1.25)
. (1.25)
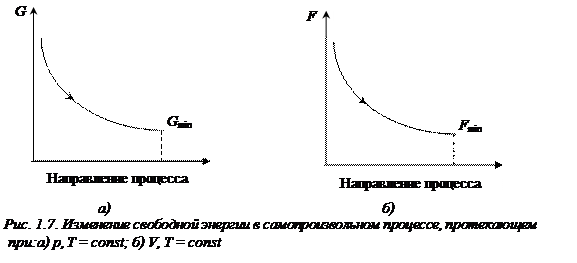
Неравенства (1.24), (1.25) являются условием самопроизвольного протекания процесса при постоянстве соответствующих параметров: самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения (рис. 1.7.).
 |
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой.
Изменение соответствующего термодинамического потенциала в ходе какого-либо процесса, протекающего при температуре Т, вычисляют по уравнению Гиббса-Гельмгольца:
– для изобарно-изотермического процесса
D G = D H – T D S, (1.26)
– для изохорно-изотермического процесса
D F = D U – T D S. (1.27)
Основываясь на уравнении Гиббса-Гельмгольца (1.26), (1.27), можно оценить вклад энтальпийного и энтропийного факторов в величину Δ G (или Δ F) и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов.
1. Экзотермические реакции, Δ H < 0.
Если Δ S > 0, то Δ G всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
Если Δ S < 0, реакция будет идти самопроизвольно при D H > T D S (низкие температуры).
2. Эндотермические реакции, Δ H > 0.
Если Δ S > 0, процесс будет самопроизвольным при D H < T D S (высокие температуры).
Если Δ S < 0, то Δ G всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
Термодинамические потенциалы могут играть роль характеристических функций. Это значит, что с помощью их производных можно выразить свойства системы, необходимые для ее характеристики.
Изобарно-изотермический потенциал является функцией двух параметров – давления и температуры, т.е.
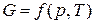 .
.
Запишем dG в виде суммы частных производных
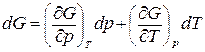 . (1.28)
. (1.28)
Учитывая, что
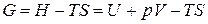 ,
,
получаем:
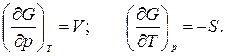
Изохорно-изотермический потенциал является функцией объема и температуры, т.е.
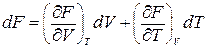 . (1.29)
. (1.29)
По определению
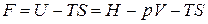 ,
,
откуда следует, что
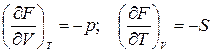 .
.
Легко установить связь между D G и D F. Вычитая из уравнения (1.26) уравнение (1.27), и учитывая, что D U = D Н – D nRT, получим:
D G = D F + D nRT.
Разберем физический смысл изобарно-изотермического и изохорно-изотермического потенциалов.
D G = D H – T D S, D F = D U – T D S;
D H = D G + T D S, D U = D F + T D S,
где D H иD U – изменение полной энергии в системе при р = const и V = const соответственно; D G иD F – энергия, которая связана с производством полезной работы; T D S – энергия, которая перешла в энергию хаотичного (теплового) движения частиц, вследствие чего она уже не может перейти в работу.
Поэтому D G иD F называют еще свободной энергией, а T D S – связанной энергией.
Т а б л и ц а
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 490; Нарушение авторских прав?; Мы поможем в написании вашей работы!