
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический потенциал
|
|
|
|
Основные понятия и определения
Критерии оценки направления самопроизвольного протекания процессов
| Характеристика системы | Критерий оценки | Условие равновесия | Условие протекания самопроизвольного процесса |
| Изолированная система | Энтропия S | Δ S = 0, S = S max | Δ S > 0 |
| Неизолированная система, р,Т = const | Изобарно-изотермический потенциал G | Δ G = 0, G = G min | Δ G < 0 |
| Неизолированная система, V, Т = const | Изохорно-изотермический потенциал F | Δ F = 0, F = F min | Δ F < 0 |
Раздел II. растворы и гетерогенные равновесия
Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях: газообразном, жидком, твердом.
Термодинамическая система, внутри которой нет поверхностей раздела, отделяющих различные либо по физическому строению, либо по химическим свойствам части системы, называется гомогенной.
Термодинамическая система, состоящая из различных по физическим или химическим свойствам частей, отделенных друг от друга поверхностями раздела, называется гетерогенной.
Любая гетерогенная система состоит из нескольких фаз.
Фаза – это часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми физическими и химическими свойствами во всех точках.
Различают однофазные, двухфазные, трехфазные и т.д. системы.
Каждая система состоит из одного или нескольких веществ, называемых компонентами.
Компоненты – индивидуальные вещества, из которых состоит система, и которые могут быть выделены из системы и существовать вне ее.
Числом независимых компонентов называется наименьшее число индивидуальных веществ, необходимое для образования данной системы. Оно равно общему числу индивидуальных веществ, входящих в данную систему, за вычетом числа уравнений, связывающих эти вещества.
По числу компонентов различают однокомпонентные, двухкомпонентные, трехкомпонентные и т.д. системы.
Любая система характеризуется внешними и внутренними параметрами состояния.
Число независимых термодинамических параметров данной системы, производное изменение которых в определенных пределах не вызывает исчезновения одних и образование других фаз называется числом термодинамических степеней свободы, или вариантностью, системы.
По числу термодинамических степеней свободы системы разделяются на инвариантные (С = 0), моновариантные (С = 1), дивариантные (С = 2) и т.д.
Раствором называется гомогенная однофазная система, состоящая не менее чем из двух независимых компонентов, в каждом элементарном объеме которого одинаковые физические, химические и термодинамические свойства.
Растворителем обычно считают вещество, количество которого в растворе больше или которое не меняет своего агрегатного состояния при образовании раствора, остальные компоненты называют растворенными.
Различают твердые, жидкие и газообразные идеальные и реальные растворы.
Идеальным называется такой раствор, все компоненты которого характеризуются одинаковой формой и размером молекул и одинаковой энергией межмолекулярных взаимодействий.
Идеальные растворы встречаются довольно редко. Это гомогенные смеси близких по физико-химическим свойствам веществ. Например, смеси оптических изомеров, соседних членов одного и того же гомологического ряда. Моделью идеального газового раствора является смесь идеальных газов. Часто к идеальным растворам относят бесконечно разбавленные растворы.
Большинство растворов являются реальными.
Реальные растворы – это растворы, компоненты которых отличаются либо по форме либо по размерам либо по энергии межмолекулярных взаимодействий.
Все свойства растворов подразделяют на экстенсивные и интенсивные.
Экстенсивные свойства – свойства, зависящие как от общей массы раствора, таки от его состава, например V, U, H, G, S, Cp.
Эти свойства относятся ко всему раствору, как единому целому, а не к отдельным его компонентам.
Интенсивные свойства – это такие свойства, которые зависят только от состава раствора и не зависят от его общей массы, например, давление насыщенного пара.
Для характеристики растворов используют средние мольные и парциальные мольные свойства.
Среднее мольное свойство – экстенсивное свойство 1 моль раствора.
Например, средний мольный объем можно рассчитать по формуле:
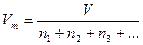 ,
,
где n 1, n 2, n 3,… – число моль первого, второго, третьего и т.д. компонентов.
Парциальное мольное свойствоi -го компонента – это частная производная от экстенсивного свойства раствора по числу молей этого компонента (ni) при постоянстве количества всех остальных компонентов и внешних параметрах (Р и Т).
Парциальное мольное свойство является характеристикой отдельного компонента системы, т.е. является интенсивным свойством раствора.
Например, парциальный мольный объем i -го компонента – это частная производная
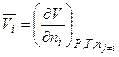 .
.
Свободная энергия системы (энергия Гиббса G и энергия Гельмгольца F) зависит от внешних условий:
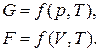
Эта зависимость является полной для простейших систем, состоящих из одного компонента.
Термодинамическая система может состоять как из одного, так и из нескольких компонентов. Очевидно, что величина свободной энергии многокомпонентной системы будет зависеть как от внешних условий (Т, р, или V), так и от природы и количества веществ, составляющих систему, т. е. свободная энергия, как и любая термодинамическая функция, является экстенсивным свойством системы.В случае, если состав системы изменяется во времени (т.е. в системе протекает химическая реакция), необходимо учесть влияние изменения состава на величину свободной энергии системы.
Рассмотрим термодинамическую систему, состоящую из k компонентов. Пусть n1, n2, …, nk – число моль 1-го, 2-го, …, k -го компонентов. Тогда свободная энергия Гиббса является функцией следующих переменных:
G = f(p, T, n1, n2, …, nk)
Продифференцируем по всем переменным:
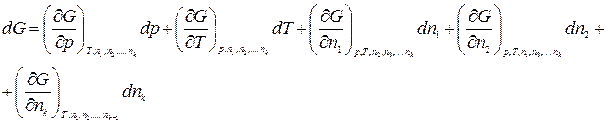 (2.1)
(2.1)
Введем обозначение:
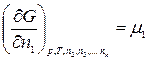
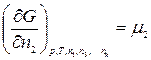
………………….
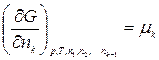 ,
,
где μ1, μ2, …, μk – химические потенциалы 1-го, 2-го, …, k -го компонентов соответственно.
В общем виде
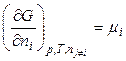 .
.
Аналогичное выражение получаем для свободной энергии Гельмгольца:
F = f(V, T, n1, n2, …, nk)
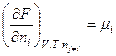 .
.
Таким образом, химический потенциал – это частная производная от свободной энергии по количеству моль i -го компонента при постоянстве соответствующих внешних параметрах и числе моль всех остальных компонентов. Таким образом, химический потенциал является парциальной мольной энергией Гиббса (при р, Т = const):
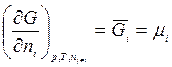 .
.
Свободная энергия – это общее свойство системы, химический потенциал характеризует свойства отдельного компонента, входящего в систему. Химический потенциал является интенсивным свойством системы, т.к. не зависит от массы системы.
При р, Т = const уравнение (2.1) имеет вид:
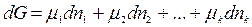 ;
;
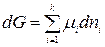 . (2.2)
. (2.2)
В этом случае изменение энергии Гиббса, то есть полезная работа системы, обусловлена только изменением состава системы в результате протекания химической реакции или вследствие обмена веществом между системой и окружающей средой.
Уравнение (2.2) выражает взаимосвязь между общим свойством системы и свойствами каждого ее компонента. Приняв, что химический потенциал является постоянной величиной, проинтегрируем уравнение (2.2):
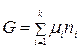 .
.
Константа интегрирования равна нулю, поскольку, если все ni = 0, энергия Гиббса также равна нулю.
Для индивидуального вещества
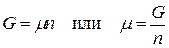 ,
,
т.е. химический потенциал индивидуального вещества равен мольной энергии Гиббса.
При равновесии dG = 0 и уравнение (2.1) принимает вид:
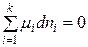 . (2.3)
. (2.3)
Полученное уравнение является общим условием равновесия в системе с переменным составом при р, Т = const.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 805; Нарушение авторских прав?; Мы поможем в написании вашей работы!